虾青素( astaxanthin,AXT )最初于1938年被发现,并首次用作水产养殖的色素。自1991年以来 , AXT已被批准作为食品补充剂的色素1。AXT的抗氧化活性是玉米黄质、叶黄素、角黄素、β- 胡萝卜素的10倍,是a-生育酚的100倍,其抗氧化活性比辅酶Q10或维生素E高约100~ 1000倍。AXT对癌症、高血压、糖尿病、心血管疾病、胃肠疾病、 肝脏疾病、神经退行性疾病和皮肤病在内的多种疾病具有潜在作用,常用于对抗病变细胞的氧化损伤。AXT在水产养殖和家禽动物饲养方面具有巨大优势。AXT能够促进动物卵巢发育、受精、孵化和幼虫生长;改善动物的免疫系统,降低死亡率,进一步避免抗生素的滥用;提高家禽品种的鸡蛋品质、蛋黄颜色、肉色和肉质 ,改善海洋生物的肉色和肉质8。AXT在食品工业、医药、化妆品和动物饲料(如鲑鱼和大虾)中的需求正在迅速增加。预计到2028年,其全球市场将达40.6亿美元。AXT的天然来源是藻类、酵母、鲑鱼、鳟鱼、磷虾、虾和小龙虾等,市售AXT主要来自红法夫酵母、雨生红球藻和化学合成。工程菌中存在核酸可能引起痛风、过敏、代谢失衡和尿结石等疾病。因此,探究工程菌中核酸的脱除方法对AXT的提取和后续应用具有重要意义。本文采用CTAB和Na Cl脱除红法夫酵母中的核酸,该方法简单有效,为利用红法夫酵母生产AXT的后续应用奠定基础。
1.1试验材料
红法夫酵母发酵液(山东金城生物药业有限公司自制,每g湿菌体核酸含为0.06-0.08g)。核酸清除剂购自山东博鹏生物技术有限公司,核酸酶购自近岸蛋白公司。CTAB/Na CI :取CTAB 4 g加Na Cl16.4g ,加水至200mL。GL-21M高速冷冻离心机(湖南湘仪实验室仪器开发有限公司)、APV2 000均质机(北京汉默泰克流体技术有限公司)、TS100恒温混匀仪(杭州瑞诚仪器有限公司)、欧莱博UV752N紫外可见分光光度计(济南爱来宝仪器设备有限公司)、LC-2030C 3D Plus高效液相色谱(日本岛津公司)、PCR仪T-96G梯度型(常州康华仪器制造厂) 。
1.2试验方法
1.2.1核酸脱除方法
取发酵完成的红法夫酵母发酵液100 g,8 000 r/min离心10 min ,之后水洗两次,菌体加水重悬至菌浓为30%的菌悬液, 650 bar高压均质2次,离心弃上清,菌体加水重悬至20%的菌悬液。按照不同核酸脱除方法及不同试剂添加量进行操作,试验设计见表1 ,每组试验设3个重复。
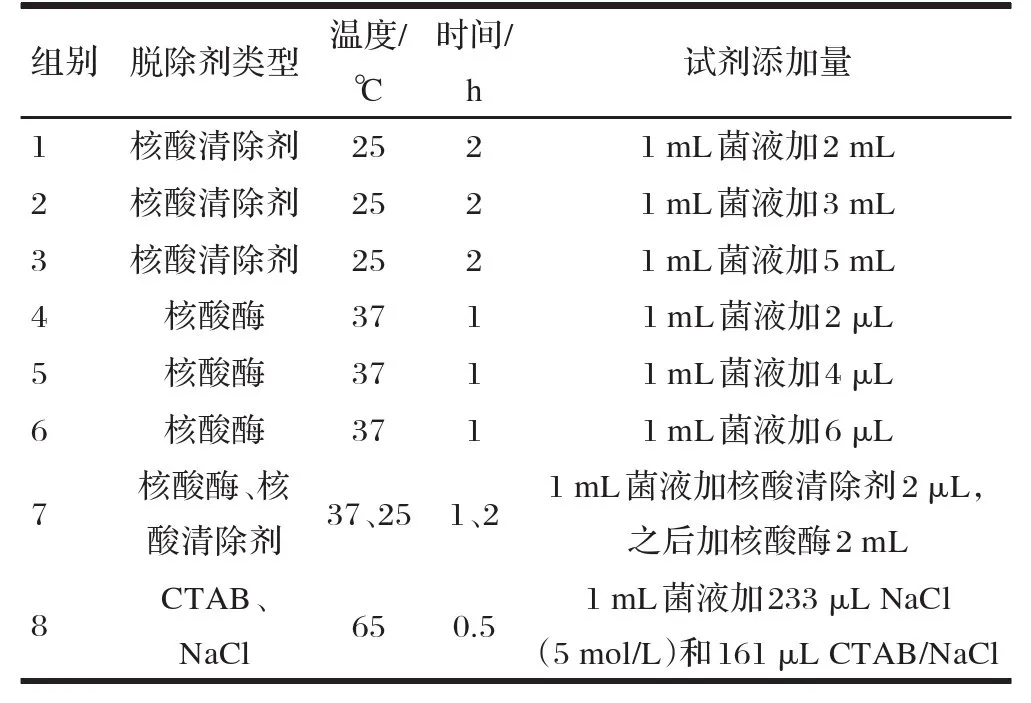
表1 试验设计
(1)核酸清除剂法。
取上述菌悬液3 mL ,分为3组,每组分别加核酸清除剂2、3和5 mL ,摇匀后置于混匀仪中, 25℃反应2 h,8 000 r/min离心10min。上清液用紫外分光光度计测定核酸脱除率 ,上清液和菌体分别进行PCR检测。
(2)核酸酶。
取上述菌悬液3 mL,分为3组,分别加核酸酶2、4和6μL ,摇匀后置于混匀仪中, 37℃反应1 h,8 000 r/min离心10 min。上清液用紫外分光光度计测定核酸脱除率,上清液和菌体分别进行PCR检测。
(3)核酸酶和核酸清除剂。
取上述菌悬液1mL,加核酸酶2μL ,摇匀后置于混匀仪中, 37℃反应1 h,8 000 r/min离心10 min,收集上清液,剩余菌体加核酸清除剂2mL,25℃反应2 h,8 000 r/min离心10 min。合并两次上清液,用紫外分光光度计测定核酸脱除率,上清液和菌体分别进行PCR检测。
(4)CTAB/Na CI法
取上述菌悬液1mL,加233μL NaCI(6 mol/L )和161μL的CTAB/NaCI ,摇匀后置于混匀仪中, 65℃反应0.5 h,8 000 r/min离心10 min。上清液用紫外分光光度计测定核酸脱除率 ,上清液和菌体分别进行PCR检测。
1.2.2虾青素含量的检测
取上述处理后的样品1 m L与5 m L的二甲基亚砜于56°C水浴反应5 min,0.22μm滤头过滤,上清液采用高效液相检测法进行检测。YMC-Carotenoid-C18色谱柱(4.6 mmx 250 mm,5μm);流动相为甲醇乙腈水溶液(80: 15:5) ;采用紫外检测器检测,检测波长为474 nm ;流速为1.5 m L/min ;柱温30℃;进样量为20μL。
1.2.3核酸含量检测
参考学者刘轲的检测方法,采用紫外分光光度计检测上清液在260 nm处的吸光值, 计算上清液总核酸含量和核酸脱除率。RNA质量浓度( mg/L)=( A200 x N)/0.024(1)核酸脱除率(%)=(菌体核酸含量,上清液核酸含量)菌体核酸含量x 100%(2)式中: A260为260 nm处的吸光值; N为稀释倍数; 0.024为1 mg/L RNA溶液的吸光值。
1.2.4 PCR检测
本试验使用的红法夫酵母为car B、car RP、Crt W和Crt Z基因重组后的工程菌,因此PCR主要检测car B、car RP、Crt W和Crt .Z基因。使用OMAGE Fungal DNA Kit试剂盒提取酵母总DNA ,反应体系为: 2xPremix10μL、.上游引物0.5μL、下游引物0.5μL、C DNA模板2μL、dd H2O 7.4μL。PCR程序为: 94℃预变性5 min;94℃变性30 s,50°C退火30 s,72℃延伸90 s,30个循环; 72℃保温5 min。用1%琼脂糖凝胶电泳检测PCR扩增产物。PCR扩增引物序列见表2。
2.1不同脱除方法试剂添加量对核酸脱除率和虾青素含量的影响(见表3)
由表3可知,核酸清除剂和核酸酶对核酸的脱除率为30% ~ 35% ,且核酸脱除率与核酸清除剂和核酸酶的用量不呈正相关。核酸清除剂和核酸酶联合使用可增加核酸脱除率,但脱除率仅55%,CTAB/Na CI核酸脱除率最高80%。初始虾青素含量为1050.07 mg/L ,经核酸清除剂、核酸酶、核酸清除剂结合核酸酶和CTAB/Na Cl处理后,虾青素含量分别为1043..38、1 045.53、1 047.77、1 035.59、1 033.24、1 036.41、1 045.59、1 033.64 mg/L。结果表明,这几种处理方法对虾青素活性无显著破坏,并且虾青素含量与核酸清除剂、核酸酶和CTAB/Na ClI的用量无明显相关性。
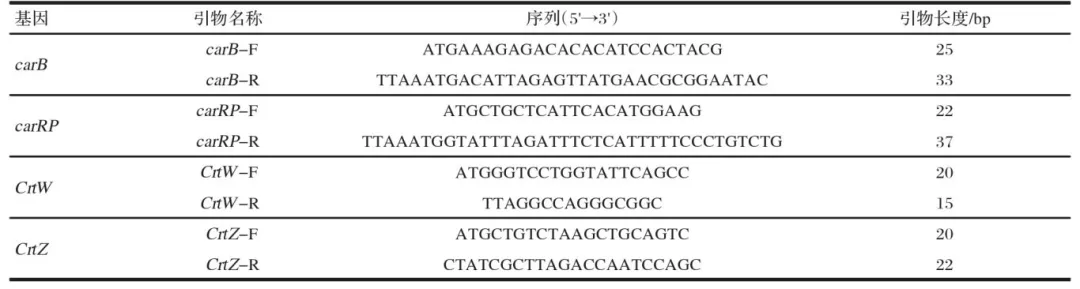
表2 PCR扩增引物序列
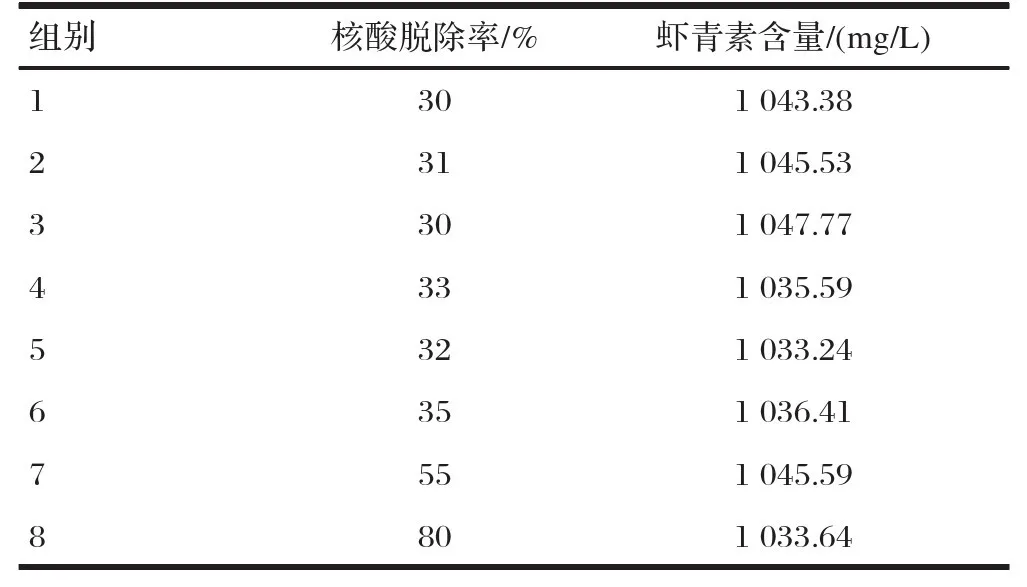
表3不同脱除方法、试剂添加量对核酸脱除率和虾青素含量的影响
2.2 不同脱除方法、试剂添加量对4条目的基因条带的去除效果(见图1-图3)
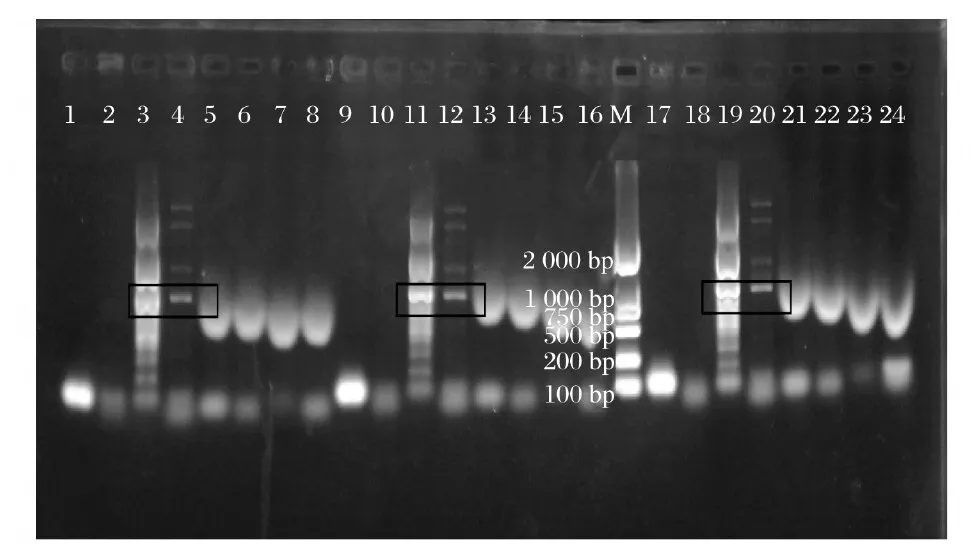
图1 1组、2组、 3组上清液和菌体的PCR检测结果
注:从左到右依次为上清液car RP、carB、 CrtW、CrtZ, 菌体car RP、car B、Crt W、Crt Z;M为Marker ;下图同图1、图2可知,经核酸清除剂和核酸酶处理后,上清液和菌体均存在Crt W(987 bp )和Crt Z(882 bp )基因。由图3可知,核酸清除剂和核酸酶联合使用后未出现条带。CTAB/Na Cl处理后也未出现条带。
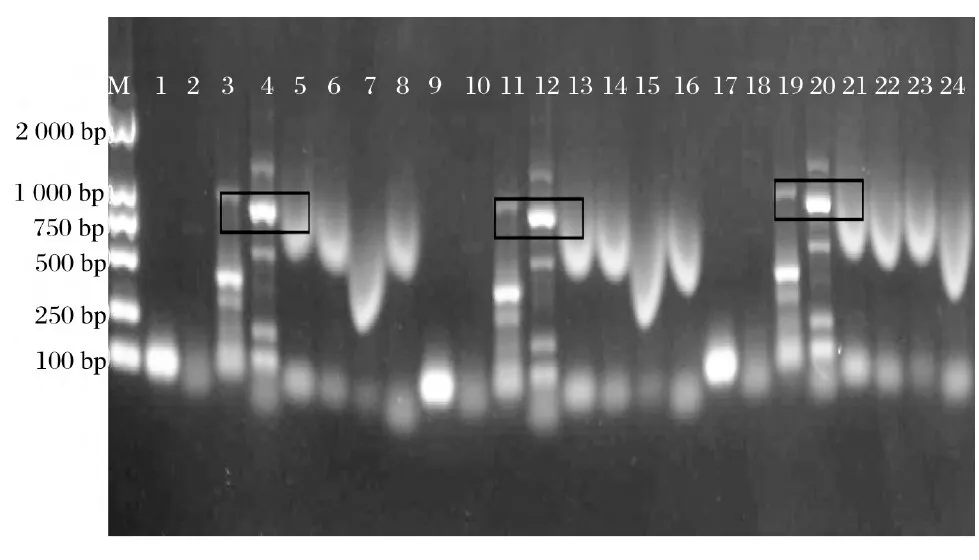
图2 4组、5组、6组上清液和菌体的PCR检测结果
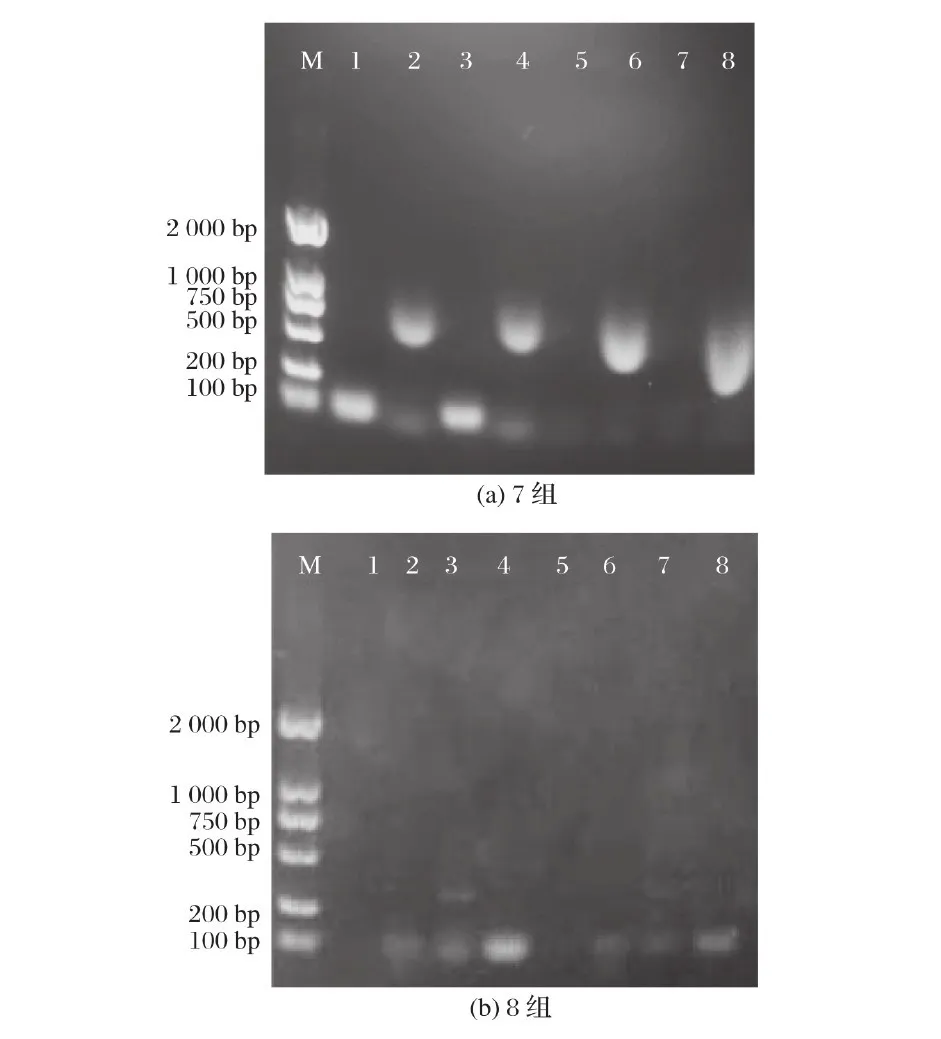
图3 7组、8组上清液和菌体的PCR检测结果
从酵母细胞中脱除核酸,首先要将酵母细胞破碎,使胞内核酸释放出来。常见的细胞破碎方式有化学法、机械法、化学法和机械法联合。细胞破壁方法不同,核酸脱除率也不同。本试验采用机械法(高压均质法)进行酵母细胞破碎。CTAB是一 种阳离子去污剂,可溶解各种膜系统,并与核酸结合形成复合物,具有一定的破壁效果。在Na CI溶液中,通过离心可将CTAB-核酸复合物与蛋白质、多糖等物质分开。刘轲比较了菌体自溶法、浓盐法、超声波细胞破碎法和浓盐与超声波破碎结合法对甲烷氧化菌核酸的脱除效果,试验结果表明,菌体自溶法对甲烷氧化菌核酸的脱除效果最佳,该处理方法条件为: Na OH调p H值为10,70℃处理50 min,菌体浓度0.9% (湿重) ,脱除率50.2%。学者王斌利用中温淡盐法脱除酵母核酸,该访法条件为:酵母浓度10%,p H值6.5,3%食盐,1.0%乙酸乙酯, 2%oβ-葡聚糖酶, 60℃处理1 h ,核酸脱除率为70%以上。刘铮利用高压脉冲电场技术脱除啤酒酵母核酸,该方法核酸脱除率为25.4%。王战勇比较了浓盐法和稀碱法对提取啤酒废酵母核酸的影响,结果表明,浓盐法的核酸提取率为6.82% ,纯度为85.45% ;稀碱法的核酸提取率为12.14% ,纯度为53.71%。本研究比较了核酸清除剂、核酸酶、核酸清除剂结合核酸酶和CTAB/Na Cl对酵母菌核酸脱除效果影响,结果表明, CTAB/Na Cl方法效果最佳,核酸脱除率80% ,该结果均高于上述研究结果。
本研究中使用的CTAB/Na Cl方法简单实惠,易产业化,核酸脱除率高,对主产品的活性无影响。CTAB/Na C|对虾青素工程菌核酸脱除的最佳工艺为:发酵液菌浓为20% ,菌悬液1 m L加233μL Na CI(6 mol/L )和161μL的CTAB/Na Cl,65℃搅拌30 min ,核酸脱除率为80%。
文章来源: 仅作科普 侵删