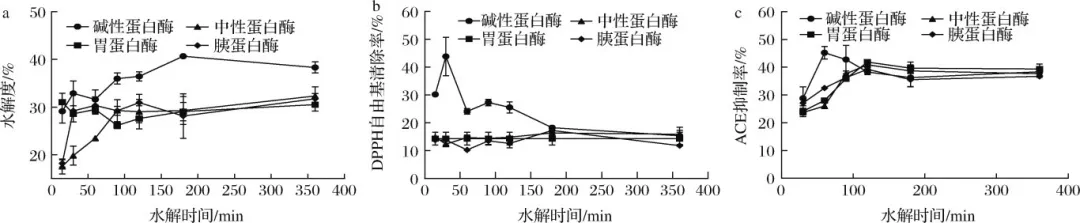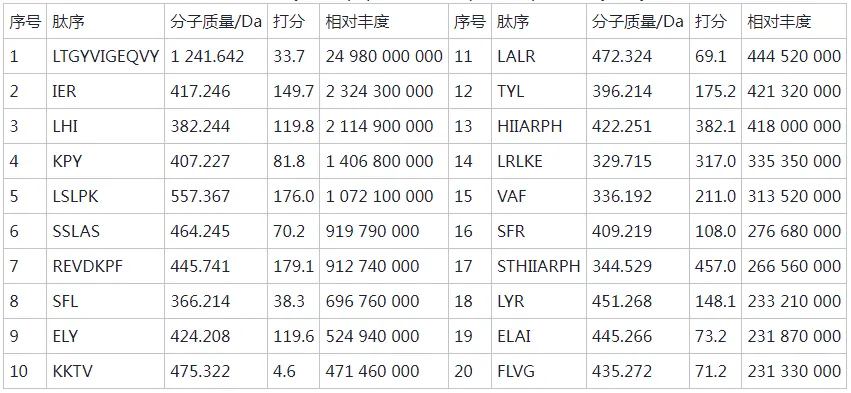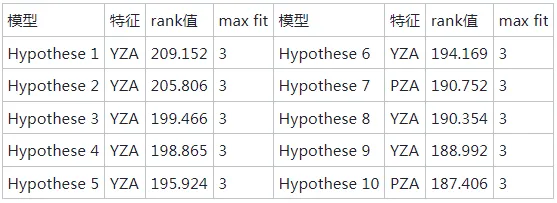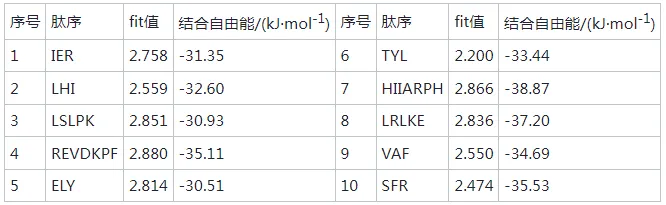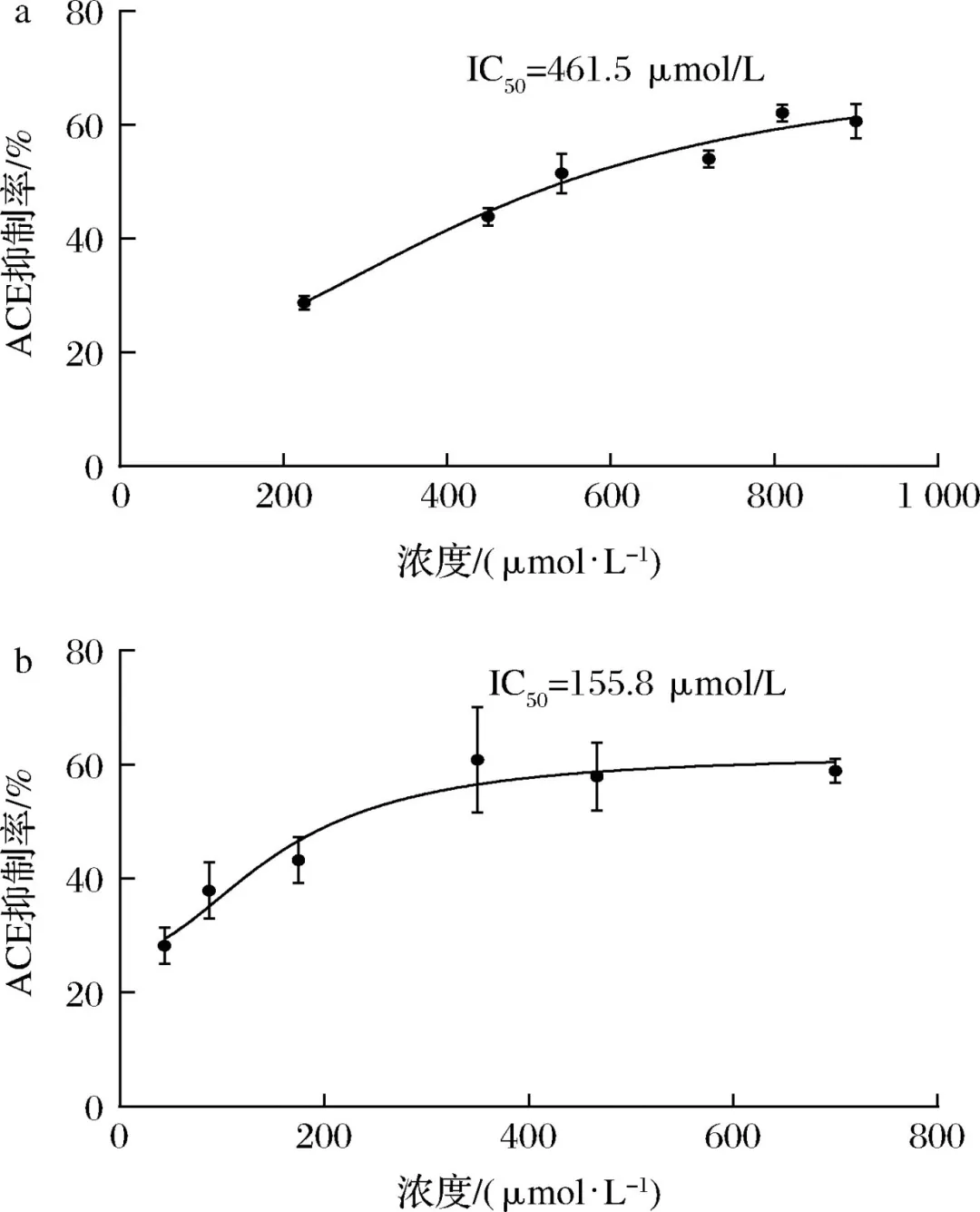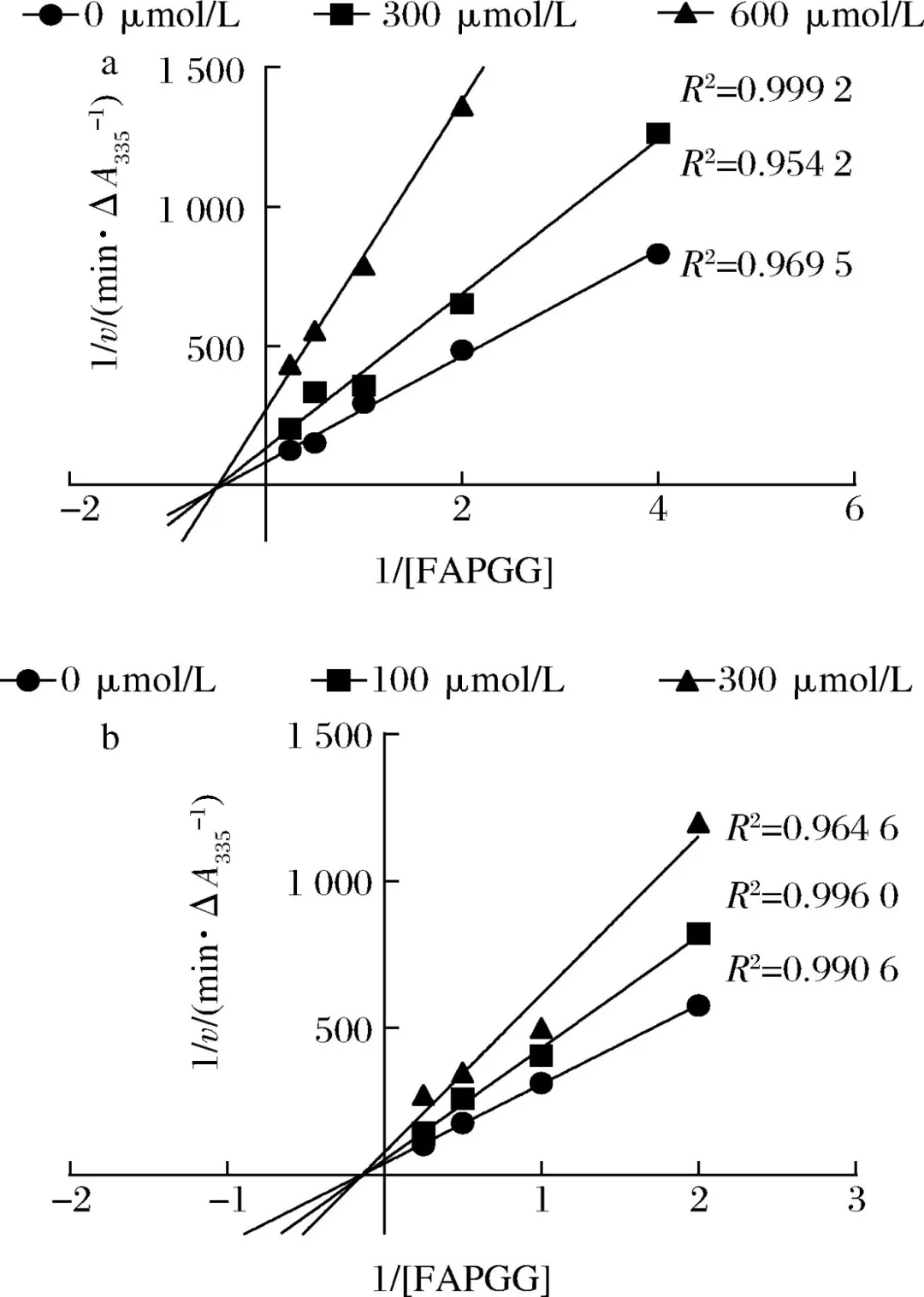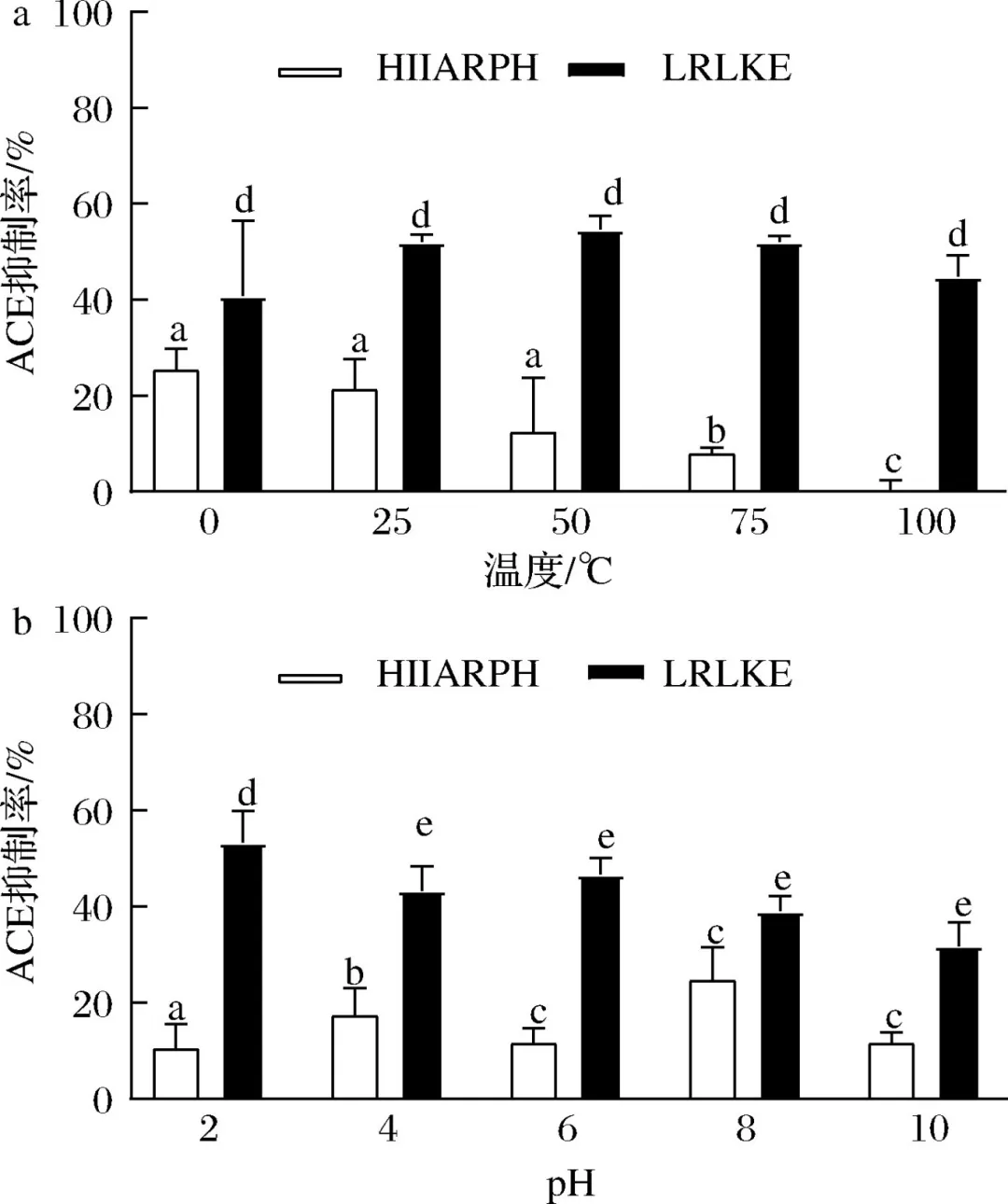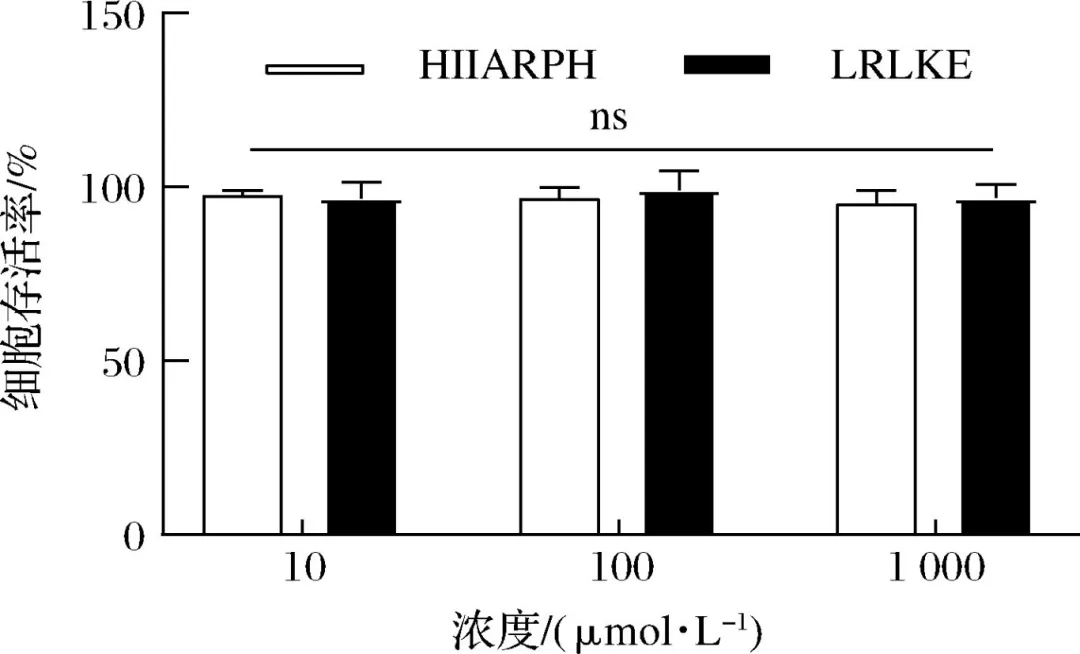
在心血管疾病中,高血压已经成为致病的主要危险因素,致死率高。随着中国人口老龄化问题加重以及代谢危险因素的流行,高血压已经成为中国面临的重要公共卫生问题。血管紧张素转化酶(angiotensin I-converting enzyme, ACE)是一种锌依赖的羧肽酶,可以通过肾素-血管紧张素系统(rein-angiotensin system,RAS)和激肽释放酶-激肽系统(kallikrein-kinin system,KKS)中的关键限速酶,在血压调控中发挥重要作用,近年来也被视为治疗高血压的重要靶点。许多合成的ACE抑制剂如卡托普利、依那普利,已经被广泛用作治疗高血压的药物。然而,长期使用这些合成的ACE抑制类药物会产生许多副作用,如干咳、头痛、皮疹甚至高钾血症。因此,寻找天然安全的新型ACE抑制剂成为了研究热点。目前,食源性蛋白水解获得的生物活性肽因其生物利用度高、毒性低、副作用少等优势引起广泛关注。例如,通过绿豆蛋白水解获得5种ACE抑制肽。常畅从棉籽蛋白水解物中分离鉴定得到3种新型ACE抑制肽(VFNNNPQE、LLSQTPRY、VFPGCPET)。螺旋藻作为最早被食用的藻类,其蛋白质含量在藻类食物中最高(60%~70%),且氨基酸种类丰富,是绝佳的生物活性肽来源。但目前,国内外对于螺旋藻来源的ACE抑制肽的报道较少。另外,传统的从食源蛋白中分离ACE抑制肽需要使用超滤、反相高效液相色谱、凝胶渗透色谱等分离方法,这些方法费时费钱,活性肽的产率低,不利于后续研究与开发。本研究以螺旋藻为原料,采用不同蛋白酶水解螺旋藻蛋白制备活性肽,通过水解度、DPPH自由基清除活性和ACE抑制活性筛选出最佳水解酶。进一步通过肽组学与计算机模拟方法,筛选具有ACE抑制活性的新型活性肽,并探究其抑制机理以及稳定性,并对细胞毒性进行评估,为食源蛋白在功能性降压食品上的应用与开发提供参考。 将螺旋藻蛋白酶解液制备后,进行水解度、DPPH自由基清除能力值、ACE抑制活性检测、基于液质联用的肽段序列分析、药效团的构建、ACE抑制肽的抑制类型分析、ACE抑制肽的稳定性分析、HUVEC细胞毒性等维度进行数据分析后得出结果。 2.1 水解蛋白酶的筛选 根据国标蛋白酶活性统一测定碱性蛋白酶、中性蛋白酶、胰蛋白酶、胃蛋白酶4种蛋白水解酶的酶活性,分别为5.17x105U/mL、3.3x105、1.0x106、2.2x105U/g. 在相同酶活力下分别用这4种蛋白酶水解螺旋藻蛋白,并测定其水解度、DPPH自 由基清除率和ACE抑制率,结果如图1所示。 由图1可知,4种蛋白酶均可水解螺旋藻蛋白并获得具有DPPH自由基清除率、ACE抑制活性的活性肽,但在相同的酶活力下,不同蛋白酶水解螺旋藻蛋白的能力具有差异。其中碱性蛋白酶水解螺旋藻蛋白的水解度、DPPH清除率以及ACE抑制率最高。据报道,碱性蛋白酶能够水解得到具有更高ACE抑制活性的肽。比较了碱性蛋白酶、风味蛋白酶、中性蛋白酶和蛋白酶K水解脱脂山羊奶,发现碱性蛋白酶水解物具有更高的水解度以及ACE抑制活性。使用碱性蛋白酶、风味蛋白酶、嗜热菌蛋白酶水解枣籽粉,发现碱性蛋白酶水解物ACE抑制活性更高。本研究同样发现碱性蛋白酶、中性蛋白酶、胰蛋白酶、 胃蛋白酶水解螺旋藻蛋白,碱性蛋白酶水解物具有更高的ACE抑制活性。据报道,通过碱性蛋白酶水解可以得到富含疏水氨基酸的肽,如C端残基为Ala、Val、Leu、Phe、Pro、lle、Met。 研究表明ACE抑制肽与ACE的结合受底物C端肽序列的强烈影响, C端含有疏水性氨基酸的肽具有显著的抑制活性,这可能是碱性蛋白酶水解物具有更高ACE抑制活性的主要原因。随着水解度的提升,碱性蛋白酶水解产物的DPPH自由基清除率以及ACE抑制率呈现先增后降的趋势,在水解时间为1 h时,即可获得DPPH自由基清除率和ACE抑制率较高的水解产物。此外考虑到碱性蛋白酶价格较为低廉,在工业生产上应用更为广泛,因此本实验选择碱性蛋白酶为水解蛋白酶,且水解时间为1h制备ACE抑制肽。 图1 不同蛋白酶水解螺旋藻蛋白的水解度、DPPH自由基清除率以及ACE抑制活性 2.2 螺旋藻蛋白水解物中的肽段鉴定结果 通过LC-MS/MS对水解液进行肽序分析并通过质谱与软件Byonic数据库检索共鉴定得到782条肽序列,理论分子质量在301.14 -2796.58 Da,相对丰度排名前20的肽段如表2所示。水解液中肽多为氨基数目在3-10的寡肽。根据打分选取排名前10的寡肽进行计算模拟,筛选具有ACE抑制潜力的寡肽。 表2 螺旋藻蛋白水解液中肽的分析 2.3 以药效团和结合能为指标的分子对接筛选ACE抑制肽以及活性验证 本研究共产生了10个药效团模型如表3所示。其中rank值是由HipHop算法对所生成的药效团的打分,代表了药效团与训练集中分子的匹配度,rank值 越高代表匹配的小分子数目越多。本研究中生成的Hypothese 1药效团的rank值最高为209.152。Hypothese 1中药效团包含了一个氢键受体(A)、一个负电离子中心(Z)和正电离子中心(Y)。fit值代表 寡肽与药效团模型的匹配度, Fit值越高,则匹配度越高,具有ACE抑制活性的潜力越大。寡肽与药效团匹配结果如表4所示,其中REVD KPF的匹配度最高, fit值为2.880。HIIARPH、 LSLPK、 LRLKE匹配度次之, fit值分别为2.866、2.851、 2.836。之后通过AutoDock、Vina软件分 别对ACE(1O86)与筛选出的10种寡肽对接,分析肽与ACE的相互作用模式,对接结果如表4所示。结合自由能越低,表示其结合越紧密。结果表明, 10种肽都能与ACE结合,其中REVDKPF、HIIARPH、 LRLKE、SFR与ACE的结合较优,结合能分别为-35.11、-38.87、 -37.20、 -35.53 kJ/mol。综合考虑药效团与分子对接的结果,共合成IER(对照)、REVDKPF、 HIARPH、 LRLKE、 SFR 5条肽段进行体外验证其ACE抑制活性,合成肽的纯度均在98%以上。 为进一步 证实所选肽的ACE抑制活性,对其体外ACE抑制活性进行测试。在100 μmol/L浓度下,以FAPGG为底物,测定5种肽对ACE的抑制潜力。FAPGG作为ACE作用的底物,能被水解为FAP和GGl10,薄层层析(thin layer chromatography, TLC)可以分离水解生成的FAP和未被水解的FAPGG。FAPGG对应条带越深表明ACE的活性越低,抑制效果越好。如图2所示, HIIARPH(P2)、LRLKE(P3)对应 的FAPGG条带较其余更深,表明他们具有更好的ACE抑制活性。因此进一步测定不同浓度下寡肽HIIARPH和LRLKE对ACE的抑制活性,结果如图3所示。通过Graphpad Prism进行曲线拟合计算HIIARPH和LRLKE的IC5o分别为461.5、155.8 μmol/L,有良好的ACE抑制活性。 最后通过分子对接进一步探讨ACE抑制肽与ACE互相作用的分子机制。ACE主 要的活性中心由S1(GIn 281、His 353、Lys 511、His 513)、S2(Glu 382、Ala 354、Tyr 523)以及S3(Glu 162)3个口袋组成。同时Zn2+作为ACE的辅酶因子在其活性位点能够与His 383、His 387以及Glu 411结合, 形成一一个四面体结构,对于整个复合物的稳定起关键作用。通过分析寡肽HIARPH和LRLKE与ACE的氨基酸残基结合情况(图4),七肽HIIARPH能与Asn 70、Arg 124、Tyr 360、Ala 354、Ala 356、Asn 522、Tyr 523等氨基酸残疾形成氢键,五肽LRLKE能与Asn 277、GIn 281、His 353、Ala 354、Cys 370、Thr 372、 Glu 384、His 513、 Tyr 520等氨基酸残基形成氢键。据报道,抑制剂酶的相互作用中,氢键的长短与数量影响了抑制剂与酶的结合力。学者李娇研究发现六肽WHAFLW因能 与活性口袋里的氨基酸残基形成氢键而活性高于七肽WFHAVFW,认为氢键是维持ACE和抑制肽结合的主要作用力。本研究所筛选出的七肽HIIARPH与五肽LRLKE都能与S1、S2中的氨基酸残基形成氢键,同时两个抑制肽都能与His 383发生相互作用, WU等[17]在研究中发现当配体与残基His 383、His 387、Glu 411之间的相互作用能够导致四面体配体的Zn2+的扭曲。此外五肽LRLKE能进一步的与S3口袋形成盐桥,同时LRLKE能与Zn2+存在相互作用,这可能是LRLKE抑制活性优于HIIARPH的原因。 注: Y为正电离子化中心; Z为负电离子化中心; A为氢键受体; P为正电排斥 表3 训练集生成的10个药效团模型参数 表4 寡肽药效团匹配打分和ACE的分子对接结果 图2 TLC法检测寡肽对ACE抑制活性 图3 HIIARPH和LRLKE的ACE抑制活性 2.4 活性肽对ACE的抑制模式分析 Lineweaver- Burk双倒数作图法常被用于确定ACE抑制肽的抑制类型。对研究中鉴定的两种ACE抑制肽HIIARPH和LRLKE分别进行ACE抑制模式的分析,并绘制Lineweaver-Burk双倒数图,结果如图5所示。两种活性肽的各系列抑制曲线都相交于横坐标轴,表明两种寡 肽的抑制模式为非竞争性抑制,即随着抑制剂浓度增加,酶促反应的米氏常数Km不变,但最大反应速度vmax变小、寡肽HIARPH和LRLKE能够和酶的非活性区结合,形成抑制肽-ACE FAPGG复合物从而降低ACE的催化活性。这与报道的来自于螺旋藻的ACE抑制肽IQP和VEp来自白酒糟中的AC E抑制肽AVQ等具有相同的抑制模式。相比较于竞争性抑制剂的强烈作用, HIARPH和LRLKE这类非竞争性抑制剂的抑制效果持续时间更长,有利于长时间保持其生理作用。 图5 HIIARPH和LRLKE对ACE的抑制Lineweaver-Burk图 2.5 ACE抑制肽的稳定性分析 目前,对ACE抑制肽的研究多数在制备、分离纯化、抑制活性和作用机制上,忽略了在后期加工生产与应用时,温度、pH等因素对ACE抑制肽活性的影响。因此,本研究进一 步探究了寡肽HIARPH和LRLKE的稳定性。 2.5.1温度对ACE抑制肽的稳定性影响 对寡肽HIIARPH和LRLKE在25-100 °C时的稳定性进行测定。由图6-a可知 ,不同的温度处理下寡肽LRLKE的ACE抑制活性均保持在40%以上(P>0.05)。但不同的温度处理后寡肽HIIARPH的ACE抑制活性有一定程度的影响。在75 ~ 100 °C,HIIARH的稳定性差, ACE抑制活性显著降低(P<0.05)。在75 °C时其抑制活性减少-伴, 100 °C时已无抑制活性。这可能是高温破坏了肽链从而使其结果变化,抑制其活性。相对而言, LRLKE的热稳定性较高,能够在热处理中保持较高的抑制活性,是一种良好的ACE抑制肽。 2.5.2 pH对ACE抑制肽的稳定性影响 不同肽具有不同的最适pH范围,并在这个范围内能表现出最好的稳定性 与活性。如图6-b所示, pH值的变化对寡肽HIIARPH和LRLKE在一定范围内有影响。在酸性(pH<6)和碱性(pH>8)条件下,寡肽HIARPH的活性都有所下降,稳定性较差。在酸性条件下, LRLKE还保持着较高的ACE抑制活性(>40%)。pH=2时 , LRLKE的抑制活性提高了约14%,可以推测在体内胃酸环境中可能有利于保持LRLKE活性。在碱性条件下, LRLKE的活性较酸性条件有所下降( <40%),与pH=6的时候相比下降了约15%。WU等21]报道了牛酪蛋白衍生的ACE抑制肽可以抵抗食品加工过程中的酸性或弱碱性条件而强碱加热下被降解或水解成无活性片段。周剑敏等22研究pH对高粱蛋白肽ACE抑制活性的影响时发现强碱性条件下ACE抑制肽的抑制活性有所降低,认为肽在强碱性环境下会发生消旋作用,改变肽结构从而导致活性降低。ACE抑制肽HIIARPH和LRLKE在强碱性条件下活性显著降低,推测是强碱性条件破坏其肽链结构,导致部分活性的丧失。而在肠胃道环境中pH<9.0,因此可以推测抑制肽在体内环境中能保持一定的活性和稳定。 图6 不同温度和pH对ACE抑制活性的影响 2.6 ACE抑制肽的细胞毒性分析 由图7可知,在测试浓度为10、100、 1 000 μmol/L的寡肽处理下, HUVEC细胞的存活率没有明显降低,存活率都> 80%,可以认为1000 μmol/L浓度下的寡肽HIIARH和LRLKE对HUVEC细胞无明显毒性(P>0.05)。这表明它们能进一步研究或开发应用于食品或者医药。 图7 两种新ACE抑制肽对HUVEC细胞活力的影响 本研究分别用碱性蛋白酶、中性蛋白酶、胰蛋白酶、胃蛋白酶水解螺旋藻源蛋白,其中碱性蛋 白酶水解物的水解度、DPPH自由基清除活性以及ACE抑制活性最优。通过肽组学手段与药效团和分子对接的方法联用,筛选出两种未被报道过的ACE抑制肽HIIARPH(461.5 umol/L)和LRLKR(155.8 μmol/L)。本研究提供的方法较传统酶解分离方法极大节约时间和成本,显著提高筛选与鉴定ACE抑制肽的效率。此外,研究发现HIIARPH和LRLKR的酶抑制动力学为非竞争抑制模式。进一步,分子对接结果表明HIIARPH和LRLKR与ACE的氨基酸残基活性口袋S1、S2形成氢键作用力,从而具有显著的体外ACE抑制活性。LRLKE能与S3口袋和Zn2+结合 ,表明其具有更佳的抑制活性。稳定性研究表明LRLKE在酸性和弱碱性条件下能够保持较好的ACE抑制活性,但是HIIARH对热和pH的较敏感,之后可以对HIIARPH进行修饰或包载以提高它在应用时的稳定性。这些结果表明,通过计算模拟可以快速筛选出具有ACE抑制活性的肽段,同时HIIARPH和LRLKE具有替代药物治疗高血压的潜在可能性。之后的工作将进一步研究这两种新的ACE抑制肽是否具有体内降压作用以及其作用机制。 文章来源: 仅作科普 侵删