
藻蓝蛋白(C-Phycocyanin, C-PC)是从螺旋藻中分离出的一类重要的捕光色素蛋白,为深蓝色粉末。藻蓝蛋白在钝顶螺旋藻藻粉中的含高达20%,富含人体8种必需的氨基酸,具有无毒、水溶性、颜色鲜艳且着色力强等特点,广泛用于食品和化妆品的着色添加剂中。同时藻蓝蛋白作为一种重要的生理活性成分,具有明显的抗氧化、抗肿瘤、抗辐射等特性,在医疗保健方面具有重要作用。藻蓝蛋白因具有强烈荧光,可作为荧光试剂,用于生物医学诊断、免疫学和高敏感荧光技术等领域。不同纯度(A620/A280) 的藻蓝蛋白有不同的用途A62o/A28o大于等于0.7时,藻蓝蛋白为食品级;A620/A280大于等于39时,藻蓝蛋白为反应级;A620/A280大于等于40时,藻蓝蛋白为分析级。
藻蓝蛋白具有十分广阔的应用前景,但传统分离纯化藻蓝蛋白的步骤繁琐,造成产品收率降低、成本增加,导致高纯度的藻蓝蛋白价格十分昂贵。本研究旨在简化藻蓝蛋白分离纯化步骤,降低生产成本,提高产品回收率和纯度,为工业化生产藻蓝蛋白提供理论基础。
称取1g藻粉溶解在100mL 0.01 mol/L PBS缓冲液(pH7.0)中,摇匀,置于超声波破碎仪中,以超声2s间歇5s的频率进行细胞破碎,总超声时间2min。细胞破碎液以8000 r/min离心15 min,取上清液,分别测定波长280、620、650 nm下的吸光值。
在藻蓝蛋白含量为0.294 mg/mL的上清液中加入硫酸铵粉末至硫酸铵的饱和度为30%,用玻璃棒搅拌10-30 min至(NH4) 2SO4充分溶解,4℃静置24h,然后8000 r/min离心15 min,收集沉淀。取上清液,再加入适量固体(NH4) 2SO4,使达50%饱和,4℃静置24h后8000 r/min离心15min,弃上清液。分别收集2种饱和度下的沉淀并用少量缓冲液溶解,0.01 mol/L PBS缓冲液(pH7.0)透析24h,分别测定沉淀液在波长为280、620、650 nm下的吸光值。
将透析后的沉淀液全部加入0.01 mol/L PBS缓冲液平衡好的羟基磷灰石(HA)柱上,羟基磷灰石为自制,参考韦萍方法,依次用6个不同离子强度的磷酸盐缓冲液进行梯度洗脱,用自动收集器收集不同梯度缓冲液的洗脱液,逐管检测各管280 nm吸光值,绘制洗脱曲线,并合并同一洗脱峰的收集管液,然后检测每个洗脱峰在波长为280、620、650 nm下吸光值。计算每个洗脱峰中藻蓝蛋白的纯度和含量。
将藻蓝蛋白纯度和含量最高的洗脱峰放入10倍于洗脱液体积的、装有20% (200 g/L)聚乙二醇中浓缩,将浓缩液加入到用0.01mol/L PBS缓冲液平衡好的DEAE Sephadex-A-25层析柱上,洗脱条件与HA柱层析相同,洗脱曲线绘制以及每个洗脱峰中藻蓝蛋白含量和纯度的计算方法同上。将纯化后藻蓝蛋白的浓缩液在荧光光谱仪上测定藻蓝蛋白的激发波长和发射波长。
利用公式,分析藻蓝蛋白的含量、藻蓝蛋白提取率。得出结果如下:
001 硫酸铵两步沉淀法
向蛋白质溶液中加入某些无机盐溶液后,盐离子破坏蛋白质周围的水化膜,降低蛋白质的溶解度,使蛋白质沉淀析出,这种作用叫作盐析。氯化钠、硫酸钠、硫酸镁、硫酸铵等无机盐常在盐析中使用。在藻蓝蛋白的初步纯化中常用硫酸铵进行盐析。采用饱和度为30%和50%的硫酸铵,对藻蓝蛋白含量为0.294 mg/mL,纯度比为0.83的样品溶液进行盐析沉淀,结果见表1。

表1 两步硫酸铵沉淀藻蓝蛋白的结果
从表1可以看出,采用两步硫酸铵沉淀法,得到的藻蓝蛋白的纯度比分别为0.86和0 .88,而藻蓝蛋白的总提取率为23.63%。有文献报道过一步硫酸铵沉淀法沉淀藻蓝蛋白,但预实验中发现藻蓝蛋白的提取率较低。
002 羟基磷灰石柱层析
羟基磷灰石(Hydroxyapatite, HA)是微溶水的弱碱性磷酸钙盐,分子式Ca10(PO4)6(OH)2是一种优良的化学吸附剂,其吸附能力受酸碱度、其他离子浓度等外界因素的影响。据文献报道藻蓝蛋白的等电点为4.5,在pH为7.0的磷酸盐缓冲液中,藻蓝蛋白带负电荷,上样过程中吸附到羟基磷灰石上,随着洗脱缓冲液盐离子浓度的增大,藻蓝蛋白被洗脱下来。
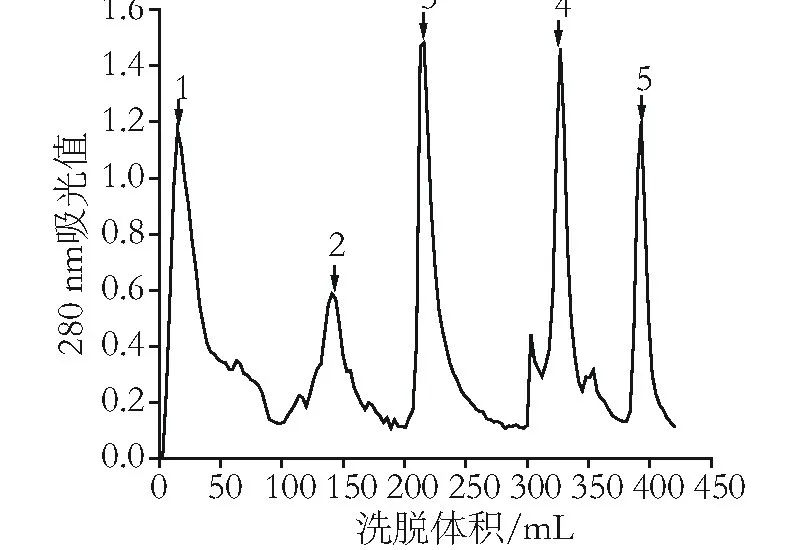
图1 藻蓝蛋白粗提液羟基磷灰石柱层析洗脱曲线

表2 藻蓝蛋白粗提液羟基磷灰石柱层析结果
结果表明,藻蓝蛋白粗提液经HA柱层析后主要得到5个洗脱峰,其中峰3中藻蓝蛋白含量最多,且纯度比最大为2.1,说明目的蛋白藻蓝蛋白主要集中在第3个洗脱峰。洗脱峰1中藻蓝蛋白含较高,可能是在上样过程中,有部分藻蓝蛋白尚未吸附就被起始缓冲液洗脱下来,其他洗脱峰中藻蓝蛋白含量和纯度比较小。
003 DEAE-Sephadex-A-25柱层析
DEAE-Sephadex A-25是以交联葡聚糖为基质的弱碱性阴离子交换剂,具有良好的结合能力,能结合带有负电荷的蛋白质,通过提高洗脱液中的盐浓度,将吸附在柱子上的蛋白质洗脱下来。羟基磷灰石柱层析中峰3的洗脱液经浓缩,得到的浓缩液藻蓝蛋白含量为0.28 mg/mL,进行DEAE-Sephadex-A-25二次层析, 1.6 cmx20 cm层析柱,柱床体积20.1 mL,上样量5.6 mL,梯度洗脱,洗脱液离子强度与HA柱层析相同,每个梯度洗脱液体积50 mL,洗脱液总体积300 mL,洗脱液流速2mL/min。结果见图2和表3。
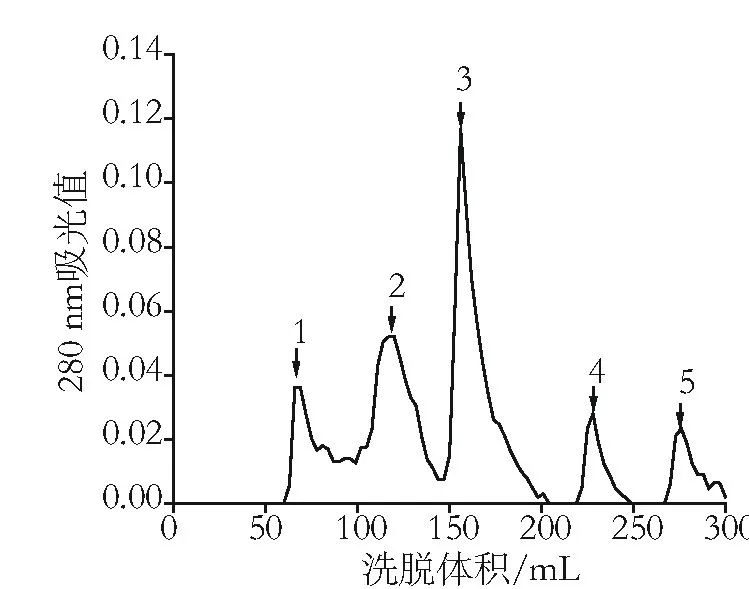
图2 DEAE-Sephadex-A-25柱层析洗脱曲线

表3 DEAE-Sephadex-A-25层析结果
结果表明,经HA层析的藻蓝蛋白样品再经DEAE-Sephadex-A-25柱层析后,共得到5个洗脱峰,其中藻蓝蛋白主要集中在洗脱峰3中,纯度比为5.4,达到了试剂级藻蓝蛋白的纯度要求。虽然洗脱峰2中藻蓝蛋白的含量仅次于洗脱峰3,但藻蓝蛋白的纯度仅为2.7,洗脱峰4和洗脱峰5中藻蓝蛋白含量较少。
采用盐析、羟基磷灰石柱层析和DEAE-Sephadex-A-25二次柱层析,所得的藻蓝蛋白的纯度比和提取率见表4。

表4 藻蓝蛋白的纯度比和提取率
由表4可以看出,藻蓝蛋白的纯度比由0.87增加到5.4,藻蓝蛋白提取率为63.1%,获得了试剂级藻蓝蛋白。
004藻蓝蛋白的荧光光谱
光谱性是藻蓝蛋白的主要特性之一,根据其最大光吸收可对藻蓝蛋白定量,采用光谱法可鉴定藻蓝蛋白的结构。简言之,光谱性是研究藻蓝蛋白结构与功能的重要方法。纯化后藻蓝蛋白样品的荧光光谱见图3和图4。
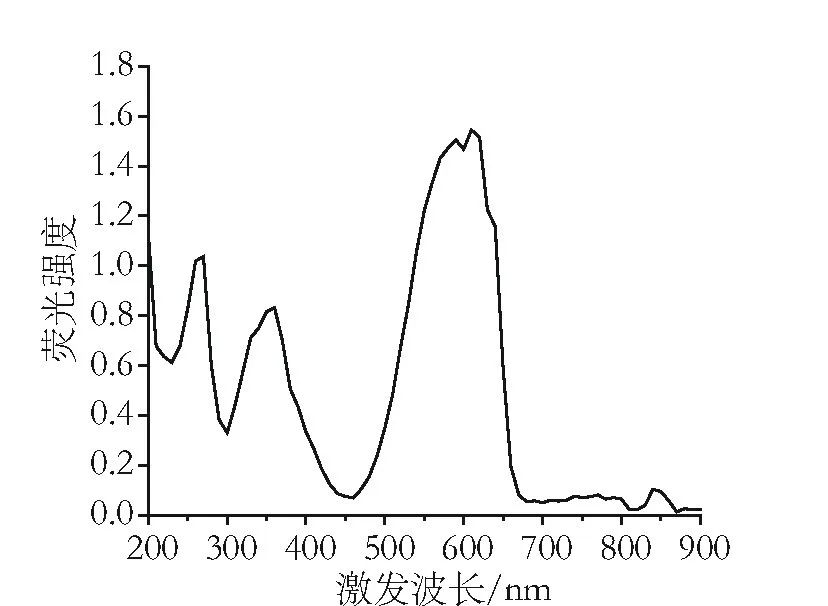
图3 藻蓝蛋白荧光激发光谱
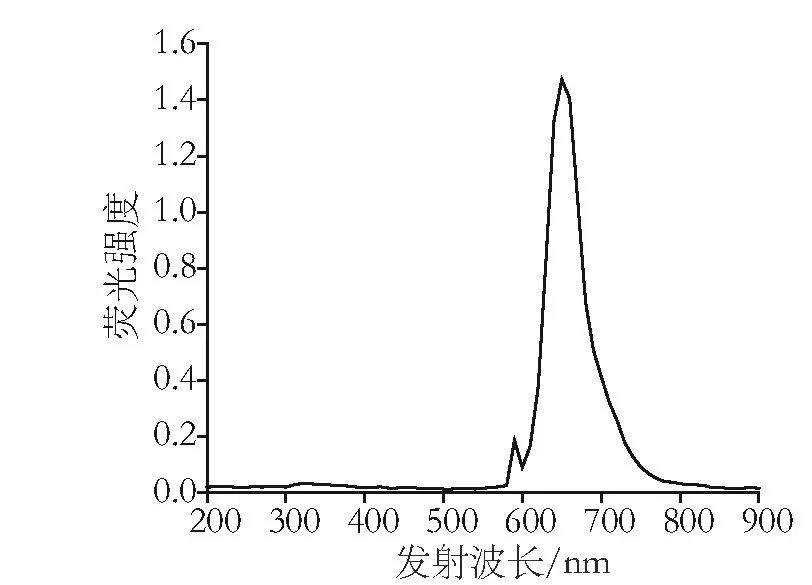
图4 藻蓝蛋白荧光发射光谱
由图3和图4可以看出,藻蓝蛋白样品的激发峰为591nm,最大荧光发射峰为652 nm。天然藻蓝蛋白在590-625 nm处产生最大吸光度,与文献报道结果相吻合,表明经过上述提取纯化工艺处理后藻蓝蛋白的结构没有发生变化。
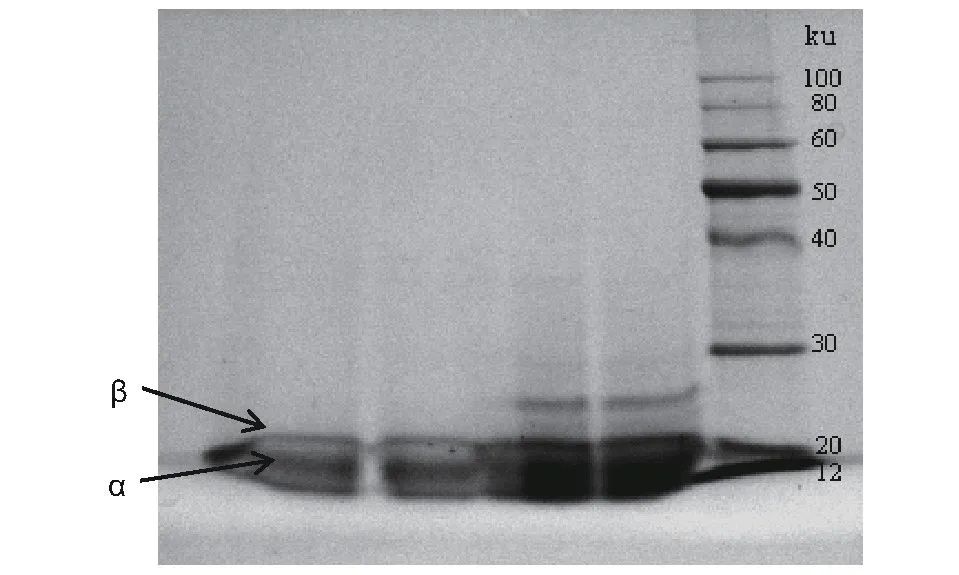
图5 藻蓝蛋白纯品经SDS-PAGE的电泳图谱
注:从右向左,第1泳道为100 ku的Marker,第2、3泳道为纯度为2。1的藻蓝蛋白样品液,第4、5泳道为纯度为54的藻蓝蛋白样品液。
纯化后的藻蓝蛋白样品经SDS-PAGE后,如图5所示,在20 ku左右有2个明显的条带,分别为藻蓝蛋白的α、β亚基,与文献报道一致。
采用柱层析技术纯化藻蓝蛋白时,洗脱液的体积要足够大,使每一洗脱液梯度下的蛋白质尽可能全部被洗脱下来,提高柱层析的分离效果。工业化生产中,采用柱层析技术不仅能提高产品质量,而且可以充分发挥现有生产设备的能力,进一步提高生产效率。实验中发现,藻蓝蛋白很不稳定,4℃放置易腐败变臭;据文献报道可通过添加剂,例如添加海藻糖、柠檬酸和甘油来改善藻蓝蛋白的不稳定性。藻蓝蛋白水溶液对光和热敏感,在温度高于45℃时部分蛋白质发生变性导致颜色的变化。
通过上述纯化步骤得到了试剂级藻蓝蛋白,荧光光谱鉴定和SDS聚丙烯酰胺电泳分析的结果也与前人的报道一致, 说明本研究中分离纯化藻蓝蛋白的方案可行,为进一步研究适合工业放大的藻蓝蛋白纯化工艺提供了理论基础。
文献出处:
[1] 于淑坤,岳思君,李敏等.钝顶螺旋藻藻蓝蛋白分离纯化[J].食品科技,2019,44(05):248-252.DOI:10.13684/
版权归原作者所有
仅作科普 侵删