雨生红球藻虾青素对糖尿病大鼠脑损伤的干预作用
中国食品学报2019年第5期
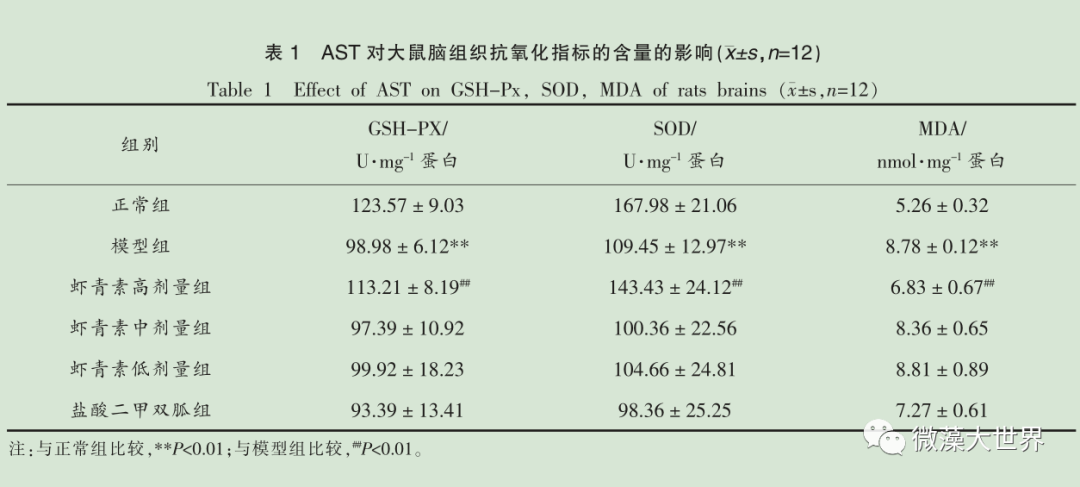
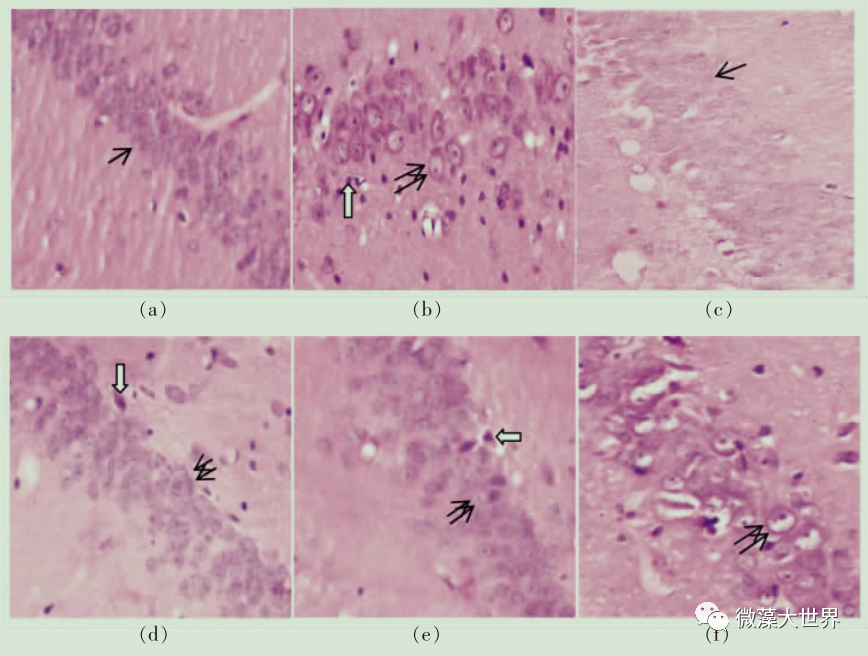
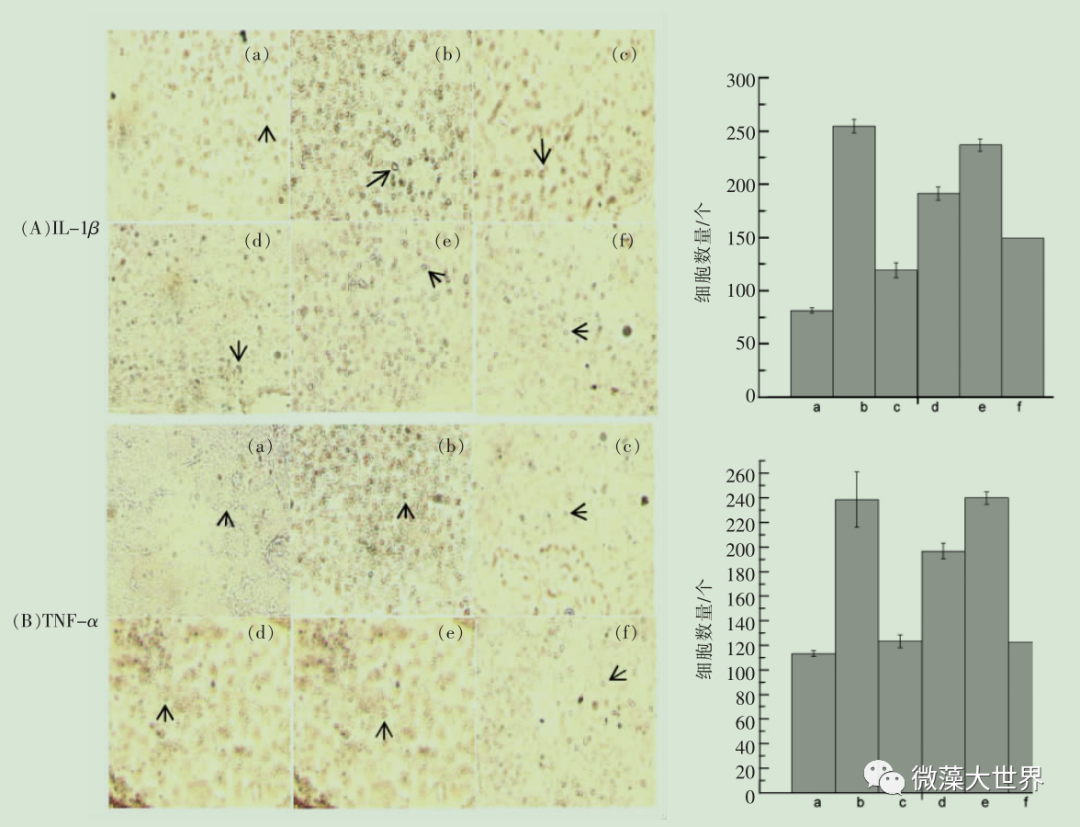
贺青华 李勇超 王文娟 任 超 赵 建 张 波* (北京联合大学生物化学工程学院 生物活性物质与功能食品北京市重点实验室 北京 100023 ) 摘要 目的 研究雨生红球藻虾青素对 2 型糖尿病大鼠脑组织的影响。 方法 72 只大鼠随机分为糖尿病模型组、正常组、雨生红球藻虾青素低剂量组【50 mg/(kg · d)】、雨生红球藻虾青素中剂量组【100 mg/(kg· d)】、雨生红球藻虾青素高剂量组【200 mg/(kg · d)】、降糖药物(盐酸二甲双胍)组,每组 12 只。 采用腹腔注射链脲佐菌素(STZ)加高糖高脂饲料制备大鼠 2 型糖尿病模型。12 周后,10% 水合氯醛麻醉处死大鼠,4 ℃ 下取其脑部,检测 GSH-Px活性、SOD活性和MDA 含量;HE 染色光镜下观察大鼠脑组织形态结构;免疫组化测定大鼠脑组织含 IL-1β 、TNF-α 的细胞数量。 结果 与模型组比较,高剂量虾青素可显著提高 2 型糖尿病大鼠脑组织 GSH-Px和SOD的活性,显著降低 MDA 的含量,显著降低 IL-1β 、 TNF-α 的细胞数量,对糖尿病大鼠脑组织结构具有保护作用。 结论 雨生红球藻虾青素对 2 型糖尿病大鼠脑组织具有保护作用, 其作用机制可能与改善大鼠脑的氧化应激反应,降低炎性因子有关。 关键词 雨生红球藻;虾青素;大鼠;糖尿病;脑 糖尿病( diabetes mellitus , DM )是由遗传和环境相互作用引起的体内胰岛素分泌不足,导致糖、脂质、蛋白质和继发的维生素、水、电解质的代谢以及氧化平衡被破坏的一种全身慢性终身性疾病, 其临床表现主要是糖代谢和脂代谢以及各种慢性并发症。 目前在世界范围内,糖尿病患病率、发病率和糖尿病患者数量急剧上升, 其常可引发一些严重的并发症,如肾病、眼病以及心血管系统病变等,严重危害人类的健康和生命 [1-6] 。 随着糖尿病及各种并发症的有效干预及治疗, 患者的生存时间延长, 大脑成为糖代谢异常作用的又一重靶器官。认知损害及痴呆也成为 T2DM 糖尿病患者晚期的重要并发症。 流行病学资料显示 T2DM患者发生痴呆的概率是非糖尿病患者的 1.5~2.5倍 [2-6] 。 糖尿病是一种终身性疾病,需要长期服用药物, 采用毒副作用小的药品来控制血糖以及并发症是非常重要的 [7-8] 。 虾青素(Astaxanthin ,AST)全称为 3,3、-二羟基 -β 胡萝卜素-4,4、- 酮,是一种红色的类胡萝卜素及天然的脂溶性色素, 广泛分布在海洋细菌、藻类、甲壳类和鱼类中等,其中雨生红球藻中虾青素的含量高达 1.5%~3% ,被公认为自然界中生产天然虾青素最好的原料之一。 近年来国内外对虾青素做了大量的研究, 现有研究表明, 天然虾青素是迄今为止发现的自然界最强大的天然抗氧化剂之一, 它能发挥强大的抗氧化作用,增强细胞的再生能力,维持机体的平衡和减少衰老细胞的堆积,在抗炎,抗癌,预防心血管疾病,增强机体的免疫,保护神经系统有着重要的作用 [9-14] 。 材料与方法 1.1 试剂 雨生红球藻虾青素, 杭州鑫伟低碳技术研发公司;链脲佐霉素( STZ ),美国 Sigma 公司;盐酸二甲双胍,华裕制药有限公司;0.1 mmol/L 柠檬酸缓冲溶液,北京鼎国昌盛生物技术有限公司。葡萄糖测定试剂盒, 中生北控生物科技股份有限公司;蛋白定量测试盒、谷胱甘肽过氧化物酶(GSH-Px) 测定试剂盒、 总超氧化物歧化酶 (T-SOD)测试盒、丙二醛(MDA)测试盒、蛋白定量测试盒,南京建成生物工程研究所;大鼠IL-1β 免疫组化试剂盒、大鼠 TNF-α 免疫组化试剂盒,北京鼎国昌盛生物技术有限公司。 1.2 仪器与设备 5804R 型低温高速离心机,德国 eppendorf 公司;电热恒温培养箱, 上海一恒科学仪器有限公司;电动匀浆器,常州朗越仪器制造有限公司;移液枪,德国 eppendorf 公司;紫外分光光度计,美国尤尼柯仪器有限公司;电子天平(CP324S 型),德国 Sartorius 公司;超级应用型纯水器(ZRXQ003T0),美国 Millipore 公司;烘干箱,德国 MMMMedcenter Einrichtungen。 1.3 实验动物 1.3.1 动物的分组与饲养 SPF 级 SD 雄性大鼠【许可证编号 SCXK (京) 2012-0001 】, 体质量(180 ± 20)g ,72 只,中国食品药品检定研究院。动物适应性饲养饲养 3 d ,称重、编号,随机分为正常组、模型组、雨生红球藻虾青素低剂量组(50 mg/kgBW)、 雨生红球藻虾青素中剂量组 (100 mg/kgBW)、 雨生红球藻虾青素高剂量组 (200 mg/kgBW)、 降糖药物 (盐酸二甲双胍:0.0285 g/100 gBW)组,每组 12 只。试验性大鼠在 SPF 屏障系统中饲养,温度控制在(20 ± 2 )℃ ,空气相对湿度50%~70%,光照周期为14 h光照(6:00-20:00)/10 h 黑暗,自由取食、饮水。 1.3.2 糖尿病模型的建立和雨生红球藻虾青素的灌胃 正常组大鼠每日给予蒸馏水和普通饲料饲养 4 周。模型组、低剂量组、中剂量组、高剂量组、降糖药物组每日给予蒸馏水和高脂高糖饲料饲养4周;禁食、不禁水12 h ,正常组腹腔注射 0.1mmol/L 柠檬酸缓冲液;模型组、低剂量组、中剂量组、高剂量组、降糖药物组腹腔注射 STZ (35 mg/kgBW),继续喂养4周, 眼眶取血测空腹血糖大于11.1 mmol/L 为造模成功,继续灌胃给予雨生红球藻虾青素4 周。 1.4 观察与测定指标 每日观察大鼠的精神状况,活动情况。 1.4.1 大鼠脑抗氧化指标的测定 取大鼠 1/4脑,称质量,制成 10% 匀浆,用于测 GSH-PX 、 SOD的活力和MDA的含量。GSH-PX、SOD 的活力和MDA 含量测定:采用谷胱甘肽过氧化物酶(GSH-Px) 试剂盒测定 GSH-PX 酶活性, 氧化物歧化酶(T-SOD)试剂盒测定 SOD 酶活性,丙二醛(MDA)试剂盒测定 MDA 的含量。以上均按试剂盒说明书操作。 1.4.2 大鼠脑组织组织病理学及免疫组化测定大鼠腹腔注射 10% 水合氯醛麻醉后,打开胸腔,暴露心脏,从左心室插入灌注针头至主动脉,剪开右心耳,快速灌注生理盐水 250~300 mL ,然后改用4% 的多聚甲醛(pH 7.2~7.4) 200~250 mL 灌注,先快后慢。快速断头、取脑,将脑组织置于 4% 多聚甲醛固定。将大鼠脑组织采用不同浓度乙醇系列脱水,再用二甲苯透明,然后石蜡包埋、切片,片厚约4 μm 。将切片按 HE 染色步骤进行染色,然后在显微镜下观察大鼠脑组织形态。免疫组化测大鼠脑组织含 IL-1β 、 TNF-α 的细胞数量。 1.5 数据处理 采用 SPSS 19.0 软件分析, 各组数据结果以x ± s 表示,并单因素方差分析。P<0.05 表示有显著性差异, P<0.01 表示有极显著性差异。 结果与分析 2.1 AST 对糖尿病大鼠脑组织抗氧化指标的影响与正常组相比,模型组大鼠脑组织的 MDA 含量显著升高 (P<0.01), SOD 和 GSH-Px 活性显著下降(P<0.01);高剂量 AST 干预后与模型组相比,MDA 含量显著下降(P<0.01), SOD 和 GSH-Px 活性显著增高(P<0.01),中、低剂量组 AST 和盐酸二甲胍与模型组相比没有显著性差异( P>0.05 )。高剂量 AST 的作用效果优于盐酸二甲双胍。 2.2 AST 对糖尿病大鼠脑组织病理学的影响HE 染色观察大鼠海马 CA1 区态学变化。光镜下观察( ×400 ),与正常组相比,模型组大鼠脑组织神经元结构层次不完整, 细胞肿胀、 细胞核固缩。与模型组相比, AST 高剂量组大鼠脑组织神经元结构层次完整性显著改善, 细胞肿胀及细胞核固缩程度明显减轻。高剂量 AST 和阳性组较糖尿病组均有明显改善,结果见图 1 。 注:( a )正常对照组(单箭头表示正常细胞核);( b )模型对照组(空心剪头表示核固缩,双箭头表示细胞肿胀);( c ) AST 高剂量组(单箭头表示正常细胞核);( d ) AST 中剂量组(空心剪头表示核固缩;双箭头表示细胞肿胀);( e ) AST 低剂量组(空心剪头表示核固缩,双箭头表示细胞肿胀);( f )阳性对照组(双箭头表示细胞肿胀)。 图 1 AST 对大鼠脑组织病理学的影响( HE,×400 )Fig.1 Effect of AST on pathological changes in the hippocampal CA1 region of rats(HE,×400 ) 2.3 2.3 AST对大鼠脑组织含炎性因子IL-1β 、TNF-α细胞数量的影响与正常组相比, 糖尿病模型组大鼠脑组织IL-1β 、TNF-α 细胞数量均显著升高 (P<0.01),AST 各剂量组对糖尿病大鼠脑组织的 IL-1β 、TNF-α 细胞数量较糖尿病模型组都显著降低(P<0.01),尤其高剂量组含量降低明显,并且效果优于盐酸二甲双胍,结果见表 2 和图 2 。 注:(a )正常对照组(单箭头表示炎性细胞);( b )模型对照组;(c ) AST 高剂量组;( d ) AST 中剂量组;( e ) AST 低剂量组;( f )阳性对照组。 图 2 AST 对大鼠脑组织炎性因子细胞数量影响(免疫组化,×200 )Fig.2 Effect of AST on cells with inflammatory factor in rats brain tissue ( immunihistochemistry,×200) 讨论 糖尿病是一种终身性疾病, 病程长且伴有多种并发症,长期慢性糖代谢紊乱可损害脑组织,使脑成为糖代谢异常作用的重要靶器官, 进而导致脑在结构、神经生理等方面发生病理改变,使其氧化应激和炎性因子水平增加 [15-16] 。寻求有效、安全的治疗药物或功能因子具有重要意义。最近有研究表明 [17-18] ,一些功能因子通过抗炎、抗氧化作用来保护大脑皮质结构和神经细胞数量, 从而延缓糖尿病脑病的发生。 本试验发现, 糖尿病模型大鼠脑中抗氧化酶SOD、GSH-PX 酶活性显著降低,MDA 和 IL-1β、TNF-α 水平明显增高。 SOD能够清除自由基,保护细胞损伤,间接地反映机体清除自由基的能力; GSH-Px 是机体内广泛存在的一种重要的催化过氧化氢分解的酶, 可以起到保护细胞膜结构和功能完整的作用; MDA 是多不饱和脂肪酸过氧化物的降解产物,与脂蛋白交联后具有较强的毒性,因此 MDA 作为衡量体内脂质过氧化的主要指标,在一定程度上反映细胞受氧化损伤的程度。 IL-1β 和TNF-α 是机体内炎性状态反应最为敏感的两种炎性因子,广泛参与了人体组织破坏、水肿形成等多种病理损伤过程。 本次试验中发现高剂量 AST 能够显著提高糖尿病大鼠脑组织SOD和GSH-PX酶活性,显著降低 MDA 含量,提高组织的抗氧化能力。显著降低含IL-1β、TNF-α的细胞数量,并对糖尿病大鼠脑组织结构具有保护作用。提示AST 改善糖尿病脑病作用的机制可能与其降低氧化应激和炎性介质的分泌有关。 结论 AST 虾青素能够改善糖尿病大鼠脑组织的氧化应激能力,降低炎性因子水平,从而对糖尿病大鼠脑组织具有一定的保护作用。