摘要: 目的:总结虾青素对肿瘤的预防和治疗作用,归纳其作用机制。方法:回顾近年来国内外发表的有关虾青素和肿瘤的中、英文文献并进行综合评述。结果:虾青素有很强的抗氧化作用。虾青素能够预防肿瘤的发生,抑制肿瘤细胞增殖, 促进凋亡,抑制转移,增强免疫,调节细胞通讯等发挥抗肿瘤作用。 结论:虾青素有一定的抑癌、抗癌作用,但其具体机制尚需进一步研究,临床应用尚需大规模前瞻性临床试验的结果。
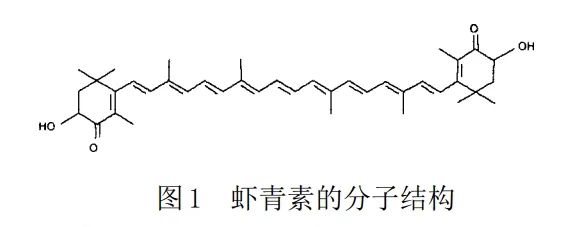
虾青素是一种类胡萝卜素,天然存在于虾蟹外壳、牡蛎、鲑鱼及雨生红球藻等生物中。虾青素化学名称为3,3’-二羟基-4,4’-二酮基-β,β’-胡萝卜素,分子式为C40H52O4(图1)。
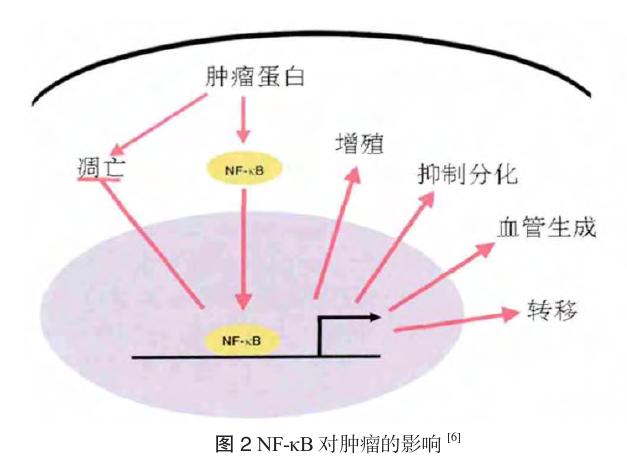
虾青素分子结构中有很长的共轭双键链,末端还有不饱和的酮基和羟基,具有较活泼的电子效应,能吸引自由基中未配对电子或向自由基提供电子,从而清除自由基,具有强抗氧化作用。其清除过氧化自由基的能力强于β-胡萝卜素、α-生育酚、α-胡萝卜素、叶黄素和番茄红素[1]。此外,虾青素在增强免疫、防治肿瘤、防治糖尿病、抗炎、预防心血管疾病、维护中枢神经系统健康等方面也有作用。已有越来越多的动物实验表明,虾青素对多种肿瘤有预防、治疗作用。本文拟对近年来虾青素抑癌、抗癌作用的研究进展做一综述。 1 虾青素对肿瘤发生的预防作用 早在20世纪90年代,Tanka T等就发现,虾青素可以降低亚硝胺诱导的ICR小鼠膀胱癌、癌前病变的发生率[2]和氧化偶氮甲烷(azoxymethane, AOM)诱导F344大鼠结肠癌的发生率[3]。Prabhu PN等[4]采用1,2-二甲肼(1, 2-dimethyl hydrazine, DMH)诱发大鼠大肠癌模型,研究发现,在用 DMH诱导之前,口服虾青素15mg/kg,可以显著减轻其组织学病变程度,延缓异常隐窝病灶的发展,并能减少嗜银核仁组成区的数目,其机制可能与虾青素的抗氧化和减轻脂质过氧化的作用有关。溃疡性结肠炎和克罗恩病会增加结直肠癌的发病风险。Yasui Y等[5]利用AOM/葡聚糖硫酸钠(dextran sulfate sodium,DSS)诱导的结肠炎相关性结直肠癌小鼠模型,发现虾青素对结肠炎和结肠炎相关性结直肠癌抑制作用,其机制可能与虾青素抑制NF-κB信号通路有关。NF-κB信号通路的激活在很多方面参与肿瘤的发生[6, 7],包括对细胞凋亡、细胞周期、分化和迁移的调控。与肿瘤发生,发展和转移相关的环氧合酶-2(cyclo oxygenases-2,COX-2)、诱生型一氧化氮合成酶 (inducible nitric oxide synthase,iNOS)、肿瘤坏死因子(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(Interleukin-1β,IL-1β)、细胞表面黏附分子、 抗凋亡蛋白等基因的表达均受NF-κB的调控,因此NF-κB是预防肿瘤的主要靶点之一。而Yasui Y 等的这项研究结果提示,虾青素可以通过NF-κB 信号通路抑制葡聚糖硫酸钠DSS诱导的炎症反应、 减轻AOM/DSS诱导的结肠增生性病变,并减少结肠炎相关性结直肠癌的发生。 环境中的化学致癌物质也是导致肿瘤的主要原因,前致癌物在I相解毒酶(如细胞色素P450) 的作用下转化为具有活性的致癌物,而II相解毒酶可以增加这些活性致癌物的亲水性,从而促进其排出体外。 Kavitha K等[8]利用7,12-二甲基苯并(a)蒽(DMBA)诱导的仓鼠颊袋肿瘤模型, 在仓鼠右侧颊袋涂0.5%DMBA诱导肿瘤发生的同时,按照15mg/(kg·bw)的剂量在其饲料中添加虾青素进行干预,发现虾青素可以预防肿瘤的产生, 其保护作用可能与其激活Nrf2/Keap-1信号通路有关。 目前,已经有多项研究确立了Nrf2信号通路的激活在肿瘤发生、发展过程中的保护作用[9-11]。 生理条件下,Nrf2在细胞质中与Keap-1结合而处于非活性、易降解的状态。在受到内外界自由基或化学物质刺激时,Keap-1的构象发生改变或者使Nrf2磷酸化,导致Nrf2与Keap-1解离而活化, 进入细胞核与抗氧化反应元件ARE结合,调节抗氧化蛋白、II相解毒酶、蛋白酶体/分子伴侣等基因转录和表达,以抵抗内外界的有害刺激。该研究结果显示,虾青素组Keap-1的表达减少,细胞核内的Nrf2增加,并可以改善DMBA导致的I 相解毒酶CYP1A1和CYP1B1表达的增加,同时降低II相解毒酶GST和NQO1。该信号通路下游的抗氧化酶类:超氧化物歧化酶(superoxide dis mutase,SOD)、过氧化氢酶、谷胱甘肽过氧化物酶 (glutathione peroxidase,GPx)表达均增加。DNA 修复酶:OGG1,XRCC1,XPD,XPG表达增加。提示虾青素可能通过激活Nrf2/Keap-1信号通路抑制仓鼠颊袋癌的发生、发展,研究者同时对几种植物化学物质上述作用进行比较,结果发现叶绿酸>蓝莓>鞣花酸>虾青素> theaphenon-E。 但是,在肿瘤发生的不同阶段应用虾青素可能会有不同的作用。Nakao R等[12]发现在肿瘤发生之前,虾青素可以调节免疫,延缓肿瘤的发展, 在肿瘤发生之后应用反而会加快肿瘤的生长速度。 而Gal AF等[13]则报道了虾青素对甲基亚硝基脲诱导的Wistar大鼠的肿瘤的产生无预防作用,仅能减轻炎症反应。这可能是因为在肿瘤发生之前应用虾青素,则在肿瘤发生的初始阶段即可达到有效的浓度,从而抑制肿瘤的发生。其他研究也表明虾青素对肿瘤的抑制作用呈明显的剂量依赖性。 而肿瘤发生之后再应用虾青素,在起始阶段不能达到有效的浓度,不能起到有效的抗肿瘤作用, 而当肿瘤发展到一定阶段,虾青素则不能起到明显的作用。 2 虾青素对肿瘤细胞增殖的抑制作用 汪振诚[14]等研究表明虾青素能明显抑制体外培养的SW1116细胞的增殖,并呈剂量依赖性。当浓度为1×10-9mol/L时,其对癌细胞生长的抑制率为23.4% ;当浓度为1×10-8mol/L时,为39.0% ; 当浓度为1×10-7mol/L时,则细胞大量死亡。 陈立武等[15]建立Hepa1-6荷瘤小鼠模型,根据虾青素处理浓度不同将24只小鼠分为对照组、低剂量组 (10mg/kg)、中剂量组(30mg/kg)、高剂量组(60mg/ kg),每组各6只,在第20天,四组肿瘤平均体积均明显增大,且对照组与低、中、高组比较, 差异均有统计学意义;虾青素中、高剂量组间差异无统计学意义。有报道称抑制5α-还原酶可以减轻良性前列腺增生的症状并可能抑制或有助于治疗前列腺癌。Anderson ML等研究发现,在体外试验中,低剂量的虾青素可以抑制5α-还原酶,进而抑制人前列腺癌细胞的增殖[16]。 虾青素抑制肿瘤增殖可能与其抑制过氧化物酶体增殖物激活受体γ(peroxysome prolifera tor-activated receptor gamma,PPARγ)活化有关。 PPARγ在乳腺癌、结肠癌、胃癌、前列腺癌、胰腺癌、 膀胱癌、肺癌、软骨肉瘤、白血病等肿瘤中都有表达,PPARγ表达的不足可能是罹患肿瘤的高危因素。激活PPARγ可以抑制肿瘤细胞的增殖和生长[17]。 Zhang X等[18]研究表明,虾青素等类胡萝卜素可以增加PPARγ的表达,抑制细胞增殖。而用不可逆性PPARγ拮抗剂GW9662,可以部分减弱类胡萝卜素对K562细胞增殖和凋亡的抑制作用,这与之前的类胡萝卜素对人乳腺癌MCF-7细胞作用的研究结果一致。该项研究还发现,虾青素等类胡萝卜素可以上调细胞周期调节蛋白激酶抑制剂p21的表达,使细胞周期蛋白cyclin D1的表达降低,cyclin D1在G1期达到最大活性,并调节G1期向S期过渡,cyclin D1水平降低使肿瘤细胞停留在G0/G1期的比例增加,从而抑制肿瘤细胞的增殖。 3 虾青素促进肿瘤细胞凋亡 虾青素可以诱导乳腺癌、肝癌、结肠癌等多种癌细胞的凋亡。其促凋亡机制可能通过激活 Erk/MAPK和PI3K/Akt从而抑制NF-κB和Wnt/ β-catenin信号通路有关。 NF-κB是一组重要的转录因子,不仅参与肿瘤的产生,与肿瘤细胞的凋亡也密切相关。NF-κB 通路的异常激活可导致一系列与肿瘤相关基因的异常表达,从而抑制肿瘤细胞凋亡,促进正常细胞转化及肿瘤血管形成和转移等,直接影响恶性肿瘤的发生和发展。在静息状态下,NF-κB和IκB 形成复合体,以无活性形式存在于胞浆中。当细胞受细胞外信号刺激后,IκB激酶复合体(IκB ki nase,IKK)活化将IκB磷酸化,使NF-κB暴露核定位位点。游离的NF-κB迅速移位到细胞核,与特异性κB序列结合,诱导相关基因转录。 激活Wnt信号通路可以抑制糖原合成酶激酶 3β(glycogen synthase kinase-3β,GSK3β)介导的磷酸化作用以及抑制胞质中的β-链蛋白(β-catenin) 降解。胞内浓度大量增加的β-链蛋白会转移进入核内,激活c-Myc基因、周期蛋白D1、基质金属蛋白酶-7(matrix metallo proteases-7,MMP-7)、小肠三叶因子-2(intestine trilobites factor-2,ITF-2) 等待定靶基因转录。 这些基因的表达产物对细胞生长、分化有重要调节作用。β-链蛋白含量增高, 促进上述基因表达,促进细胞增殖。缺乏Wnt信号时,核内β-链蛋白可与APC/GSK-3β、Axin形成复合体,并从细胞核输出到胞液,在胞液中经过泛素化修饰而被蛋白酶体降解。β-链蛋白含量降低,上述基因转录下调,从而抑制细胞生长。 种种原因导致的核内β-链蛋白含量持续增高可能是细胞发生癌变的关键因素之一。 Kavitha K等[19]研究发现虾青素可以通过下调 pIKKβ和IKKβ的表达,减少IκB-α的降解,从而减少NF-κBp65的核转运。而且,虾青素可以抑制 NF-κBp65ser276的翻译后磷酸化,从而影响其与 DNA结合和转录调节作用。这些发现与其他不同动物模型研究中虾青素对NF-κB信号通路作用的研究结果相一致[20]。虾青素可以下调pGSK-3βs er9,从而减少β-链蛋白的核转运,抑制Wnt/ β-catenin信号通路。 该研究表明,虾青素对IKKβ/ NF-κB和GSK3β/β-链蛋白信号通路的抑制作用可能是通过抑制其上游信号激酶Erk/MAPK和PI3K/ Akt来实现的。虾青素通过抑制NF-κB和Wnt/ β-catenin信号通路调节其下游的靶基因如抗凋亡蛋白(B cell lymphoma-2,Bcl-2)、凋亡相关基因 (Bcl-2-associated X,Bax)和存活素的表达。促凋亡蛋白Bax通过与线粒体膜结合,形成渗透性膜转移孔复合物,建立线粒体膜通道,介导促凋亡分子,细胞色素C和Smac/Diablo等的释放,从而激活半胱天冬酶级联反应,主要通过半胱天冬酶-3 (caspase-3),激活破坏基因组DNA的核酸内切酶 ,造成基因组DNA裂解;失活DNA修复相关酶, 造成D N A修复能力降低;分解细胞骨架等凋亡执行过程[21]。而Bcl-2可以通过拮抗Bax而抑制凋亡[22]。 Bad(Bcl-2-associated death protein)根据其磷酸化状态对细胞的凋亡起双向作用,去磷酸化促进凋亡,Akt引起的Bad的磷酸化可抑制细胞凋亡。存活素出现在胞质中可以抑制Smac/Diablo 和半胱天冬酶,在细胞核内则促进凋亡。该研究发现虾青素可以显著提高Bax/Bcl-2,下调p-Bad, 提高核内生存素水平并降低细胞内生存素的表达, 从而促进肿瘤细胞凋亡。 Lordan S等[23]的研究也发现虾青素通过下调 Akt的活性而诱导U937细胞的凋亡。最近的一项研究也表明虾青素通过调节Erk-2, NF-κB和环氧合酶-2(cyclooxygenases-2,COX-2)的表达来促进二甲肼诱导的大鼠结肠癌细胞的凋亡[25]。 4 虾青素抑制肿瘤转移 肿瘤的转移具备下述条件:①不断增殖的肿瘤细胞;②细胞外基质降解,组织重塑,分离脱落的肿瘤细胞侵入细胞外基质并进入脉管系统; ③肿瘤细胞的运动及趋化;④新生毛细血管的形成。虾青素对肿瘤转移的抑制,除了与前述癌细胞自身增殖受阻并发生凋亡有关外,可能与对 MMPs、NK细胞的调控有关。MMPs是降解细胞外基质的主要酶类,可以有效的破坏基底膜,另外还可以促进新生血管的形成,调节细胞间的黏附,从而促使肿瘤发生侵袭和转移。Nagendrapra bhu P等[24]发现,DMH诱导的大鼠结肠癌肿瘤模型中MMP-2和MMP-9表达增加,虾青素可以降低MMP-2和MMP-9水平,从而抑制肿瘤的侵袭和转移。 对接种了P815肥大细胞瘤细胞并受到束缚刺激的小鼠,虾青素可以显著减少肿瘤的肝转移[25]。 其机制可能与虾青素增加NK细胞(natrual killer cell)的活性有关。已有报道,束缚应激可以增加血浆和肺中脂质过氧化水平[26, 27],该研究也发现束缚应激促进了肝脏组织的脂质过氧化作用。NK 细胞易受ROS(reactive oxygen species)影响而失活[28]。 所以,束缚应激可以通过促进脂质过氧化而减弱NK细胞的活性。而NK细胞有抗肿瘤和抑制肿瘤转移的作用[29, 30]。故虾青素可能通过其抗氧化作用减弱束缚应激对NK细胞活性的损害, 从而抑制肿瘤转移。 5 虾青素增强免疫 裴凌鹏等[31]发现虾青素对昆明小鼠S180肉瘤的生长有一定的抑制作用,能够增加免疫器官的脏器指数、肿瘤抑制率,且明显增强S180荷瘤小鼠T淋巴细胞百分数,说明虾青素可能通过增强荷瘤小鼠的免疫功能而达到抗肿瘤的作用。陈立武等[15]利用Hepa1-6荷瘤小鼠模型腹腔注射不同剂量的虾青素,观察到虾青素可以增加荷瘤小鼠的脾细胞数量,并呈剂量依赖性,同时还能显著增强宿主淋巴细胞对肿瘤细胞的杀伤作用。提示,虾青素可以提高荷瘤小鼠的免疫水平,进而发挥杀伤肿瘤细胞的作用。虾青素增强免疫的作用机制可能与其强大的抗氧化功能有关。虾青素的抗氧化作用可以保持机体的自稳态,保证细胞间隙正常的连接通讯,从而促进淋巴细胞间的相互作用并分泌有免疫活性的细胞因子,提高宿主的免疫水平。 Jyonouchi H等[32]发现,在BALB/c小鼠接种 Meth-A肿瘤细胞的当天应用虾青素与对照组相比, 肿瘤的重量、大小差异无统计学意义,而在接种前一周和三周时应用虾青素,肿瘤的大小和重量则显著减低。其对肿瘤的抑制作用可能与虾青素增强免疫有关。肿瘤接种后细胞毒性T淋巴细胞 (cytotoxic T lymphocyte,CTL)活性和γ干扰素 (interferon-γ,IFN-γ)水平升高。添加虾青素可以扩大其增高幅度,从而提高宿主的免疫水平。 6 虾青素增加细胞间通讯 细胞间隙连接通讯在肿瘤发生过程中扮演着极为重要的角色。众多研究表明,细胞间隙连接通讯功能异常可能是肿瘤发生的重要机制之一[33]。 彭光华等[34]研究表明虾青素对乳腺癌细胞MDA MB-435S和MCF-7细胞的细胞间隙连接通讯有较强的促进作用。 虾青素增强细胞通讯的机制可能与增加细胞通讯蛋白43(connexin43,Cx43)的表达有关。细胞间隙连接通讯的功能基础是细胞缝隙连接(gap junction,GJ),其中,Cx43是构成GJ的重要蛋白之一。Vine AL等[35]研究发现,虾青素可以上调Cx43基因的表达,其mRNA水平和蛋白质水平都有提高。Cx43mRNA水平的增加不会被环十二碳三烯所抑制而且其活性与mRNA的半衰期无关,提示转录激活的直接作用。虾青素对 Cx43表达的促进作用不能被类维生素A核受体阻断剂所抑制,而能被PPAR-γ拮抗剂GW9662所抑制,其机制是否与激活PPAR-γ有关尚需进一步研究。 但是,也有一项研究提示虾青素对肿瘤细胞间隙连接通讯没有显著影响,甚至会抑制细胞通讯[36],可能是因为虾青素会导致Cx43的磷酸化, 抵消了Cx43的表达增加所带来的益处。 6 展望 肿瘤是严重威胁人类生命的重大疾病。常用的治疗手段主要有手术、放疗、化疗、免疫治疗、 中医中药治疗等,但大部分恶性肿瘤仍缺乏有效的治疗方法,而且传统的放疗化疗方法副作用较大, 给患者带来巨大的身心压力,患者常因为不能耐受其副作用而放弃治疗。因此探讨抗肿瘤的新疗法成为现今医学界的重要任务。如上所述,已经有越来越多的动物实验证明了虾青素对多种肿瘤的预防和治疗作用,并对其机制进行了探索,发现可能与抑制NF-κB信号通路和Wnt/β-catenin信号通路,激活Nrf2/Keap-1信号通路,抑制PPARγ 活化,降低MMPs的表达,增加Cx43表达等有关。 但其具体机制尚不明确,有待进一步研究。 文章来源:[1]吕亭亭.虾青素抗肿瘤作用的研究进展[J].肿瘤代谢与营养电子杂志,2015,(4):58-62.